国家药监局综合司公开征求《关于做好第三批实施医疗器械唯一标识工作的公告(征求意见稿)》意见
为进一步贯彻落实《医疗器械监督管理条例》《国务院办公厅关于印发治理高值医用耗材改革方案的通知》和国务院深化医药卫生体制改革有关重点工作任务,推进医疗器械唯一标识在监管、医疗、医保等领域的衔接应用,国家药监局组织起草了《关于做好第三批实施医疗器械唯一标识工作的公告(征求意见稿)》(见附件),现公开征求意见。
请将修改意见和建议于2022年12月30日前反馈至电子邮箱:mdct@nmpa.gov.cn,邮件标题注明“UDI第三批实施”。
联系人及电话:董谦,010-88330608。
附件:关于做好第三批实施医疗器械唯一标识工作的公告(征求意见稿)
附件:
关于做好第三批实施医疗器械唯一标识工作的公告
(征求意见稿)
附:
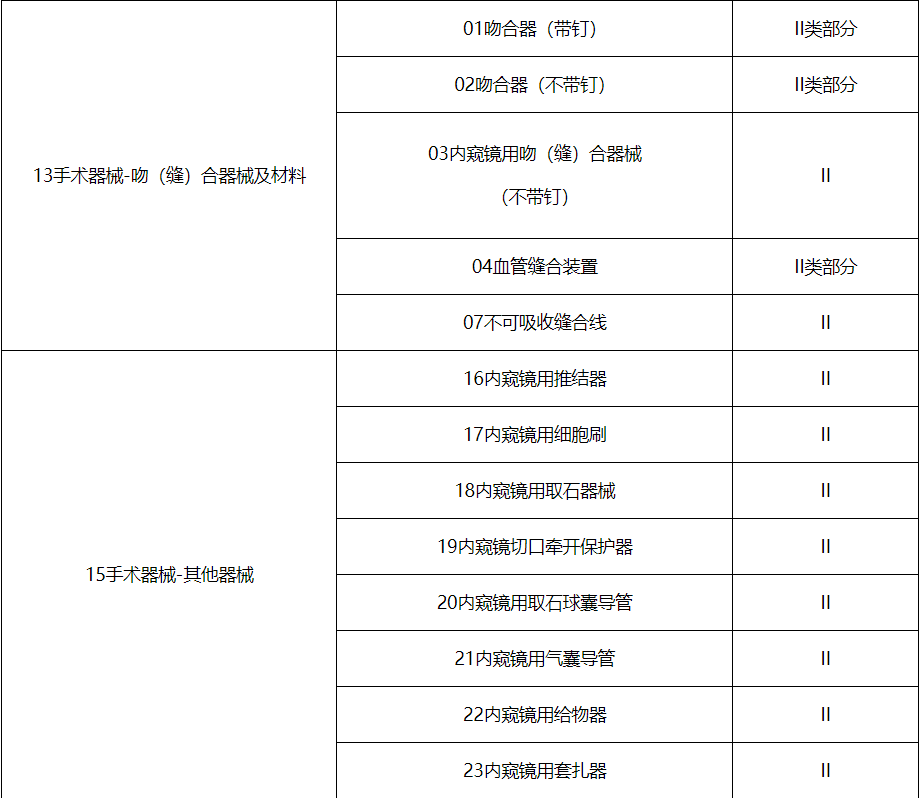
第三批实施医疗器械唯一标识的产品目录








一级产品类别 |
二级产品类别 |
管理类别 |
03光治疗设备 |
01激光治疗设备 |
II类部分 |
02光动力激光治疗设备 |
II类部分 |
|
04强脉冲光治疗设备 |
II |
|
05红光治疗设备 |
II |
|
06蓝光治疗设备 |
II |
一级产品类别 |
二级产品类别 |
管理类别 |
03血液净化及腹膜透析设备 |
06腹膜透析设备 |
II |
04血液净化及腹膜透析器具 |
04腹膜透析器具 |
II类部分 |
一级产品类别 |
二级产品类别 |
管理类别 |
01心脏节律管理设备 |
10起搏系统分析设备 |
II |
11心脏节律管理程控设备 |
II |
|
12连接器套筒 |
II |
|
02神经调控设备 |
07测试刺激器 |
II |
08测试延伸导线 |
II |
|
09神经调控程控设备 |
II |
|
03辅助位听觉设备 |
02体外声音处理器 |
II |
03辅助位听觉调控设备 |
II |
|
04其他 |
01植入式心脏收缩力 调节设备 |
II类部分 |
一级产品类别 |
二级产品类别 |
管理类别 |
01注射、穿刺器械 |
01注射泵 |
II类部分 |
04笔式注射器 |
II |
|
07注射器辅助推动装置 |
II类部分 |
|
08穿刺器械 |
II |
|
09活检针 |
II |
|
02血管内输液器械 |
01输液泵 |
II类部分 |
12药液用转移、配药器具 |
II |
|
05非血管内导(插)管 |
02经鼻肠营养导管 |
II |
03导尿管 |
II类部分 |
|
04直肠管(肛门管) |
II类部分 |
|
05输尿管支架 |
II类部分 |
|
06引流导管 |
II |
|
07扩张导管 |
II |
|
08造影导管 |
II |
|
09测压导管 |
II |
|
06与非血管内导管配套用体外器械 |
01颅脑外引流收集装置 |
II |
02胸腔引流装置 |
II |
|
05负压引流海绵 |
II类部分 |
|
06负压引流封闭膜 |
II |
|
12造口、疤痕护理用品 |
02疤痕修复材料 |
II |
14医护人员防护用品 |
01防护口罩 |
II |
02防护服 |
II |
一级产品类别 |
二级产品类别 |
管理类别 |
03视光设备和器具 |
03视觉治疗设备 |
II |
04眼科测量诊断设备 和器具 |
01眼科激光诊断设备 |
II类部分 |
05眼科治疗和手术设备、辅助器具 |
04眼科冷冻治疗设备 |
II |
06眼科治疗和手术辅助器具 |
II类部分 |
|
07眼科植入物及辅助器械 |
14义眼片 |
II类部分 |
15人工晶状体、人工玻璃体 植入器械 |
II类部分 |
|
16 囊袋张力环植入器械 |
II类部分 |
一级产品类别 |
二级产品类别 |
管理类别 |
01妇产科手术器械 |
05妇产科用扩张器、牵开器 |
II类部分 |
10子宫输卵管造影、输卵管 通液器械 |
II类部分 |
|
04妇产科治疗器械 |
02妇科假体器械 |
II类部分 |
07辅助生殖器械 |
01辅助生殖导管 |
II |
02辅助生殖穿刺取卵/精针 |
II |
|
03辅助生殖微型工具 |
II |
一级产品类别 |
二级产品类别 |
管理类别 |
01认知言语视听障碍康复设备 |
07助听器 |
II |
一级产品类别 |
二级产品类别 |
管理类别 |
01血液学分析设备 |
02血细胞分析仪器 |
II |
11采样设备和器具 |
04静脉血样采血管 |
II |

















