
为进一步规范医疗器械通用名称,加强医疗器械全生命周期管理,国家药品监督管理局组织制定了《有源手术器械通用名称命名指导原则》《物理治疗器械通用名称命名指导原则》《患者承载器械通用名称命名指导原则》《眼科器械通用名称命名指导原则》《注输、护理和防护器械通用名称命名指导原则》和《临床检验器械通用名称命名指导原则》,现予发布。
1.有源手术器械通用名称命名指导原则
2.物理治疗器械通用名称命名指导原则
3.患者承载器械通用名称命名指导原则
4.眼科器械通用名称命名指导原则
5.注输、护理和防护器械通用名称命名指导原则
国家药监局
2022年5月26日
本文摘选附件1:
有源手术器械通用名称命名指导原则
本指导原则依据《医疗器械通用名称命名规则》和《医疗器械通用名称命名指导原则》制定,用于指导有源手术器械通用名称的制定。
本指导原则是对备案人、注册申请人、审查人员的指导性文件,不包括注册审批所涉及的行政事项,不作为法规强制执行。若有满足相关法规要求的其他方法,也可采用,并应提供充分的研究资料和验证资料。本指导原则是在现行法规和标准体系以及当前认知水平下制定的,应在遵循相关法规的前提下使用。随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
本指导原则适用于以手术治疗为目的与有源相关的医疗器械,主要包括超声、激光、高频/射频、微波、冷冻、冲击波、手术导航及控制系统、手术照明设备等医疗器械。
有源手术器械核心词是对具有相同或者相似的技术原理、结构组成或者预期目的的医疗器械的概括表述。如“超声软组织手术设备”“激光手术设备”“高频手术设备”等。
——引导方式:指引导超声聚焦的方式,如“超声引导”“磁共振引导”。
——脉冲特性:指激光在时间特性上的输出方式,如“长脉冲或连续”“调Q”等。
——工作物质:指用来实现粒子数反转并产生光的受激辐射放大作用的物质,如“二氧化碳”“半导体”等。
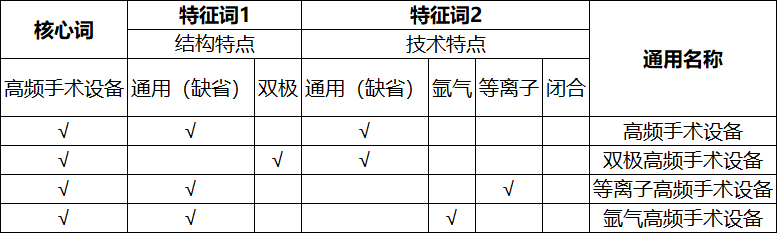
——技术特点:对产品特殊作用原理、机理或者特殊性能的说明或者限定,如“等离子”“氩气”。
——结构特点:对产品特定结构、外观形态的描述,如“针状”“环状”。
——制冷剂:指完成能量转化的媒介物质,如“液氮”“二氧化碳”。
——使用光源:指手术照明设备采用的光源,如“LED”
——使用形式:分为“可重复使用”和“一次性使用”。可重复使用医疗器械指处理后可再次使用的医疗器械。一次性使用医疗器械指仅供一次性使用,或在一次医疗操作过程中只能用于一例患者的医疗器械。
——提供形式:分为“无菌”和“非无菌”。无菌医疗器械指以无菌形式提供,直接使用的医疗器械产品。
——适用场景:指产品适用的临床使用范围,如骨科、脊柱外科等。
——使用部位:指产品在人体的作用部位,如关节、鼻窦等。
术语表中某一特征词项下的惯常使用或公认的某一特性可设置为“缺省”,在通用名称中不做体现,以遵从惯例或方便表达的处理方式。如医用光纤有“一次性使用”和“可重复使用”两种,因此,“可重复使用”这一特征词可缺省,仅体现“一次性使用”的情况。
有源手术器械通用名称按“特征词1(如有)+特征词2(如有)+特征词3(如有)+核心词”结构编制。
核心词和特征词应根据产品真实属性和特征,优先在术语表中选择。对于术语表未能包含的,新产品或原有产品有新的特征项需要体现,或者需在某一特征项下加入新术语,可对术语集进行补充或调整。
核心词应在该类别项下选择最适合产品属性的核心词,核心词不可缺省。特征词则应按照产品相关特征,依次在术语表中每个特征词项下选择一个与之吻合的术语。
本指导原则将仅含有手术部件的微波治疗设备的核心词命名为“微波手术设备”。对于既含有手术部件又含有理疗部件的微波治疗设备,建议命名为“微波治疗仪”。
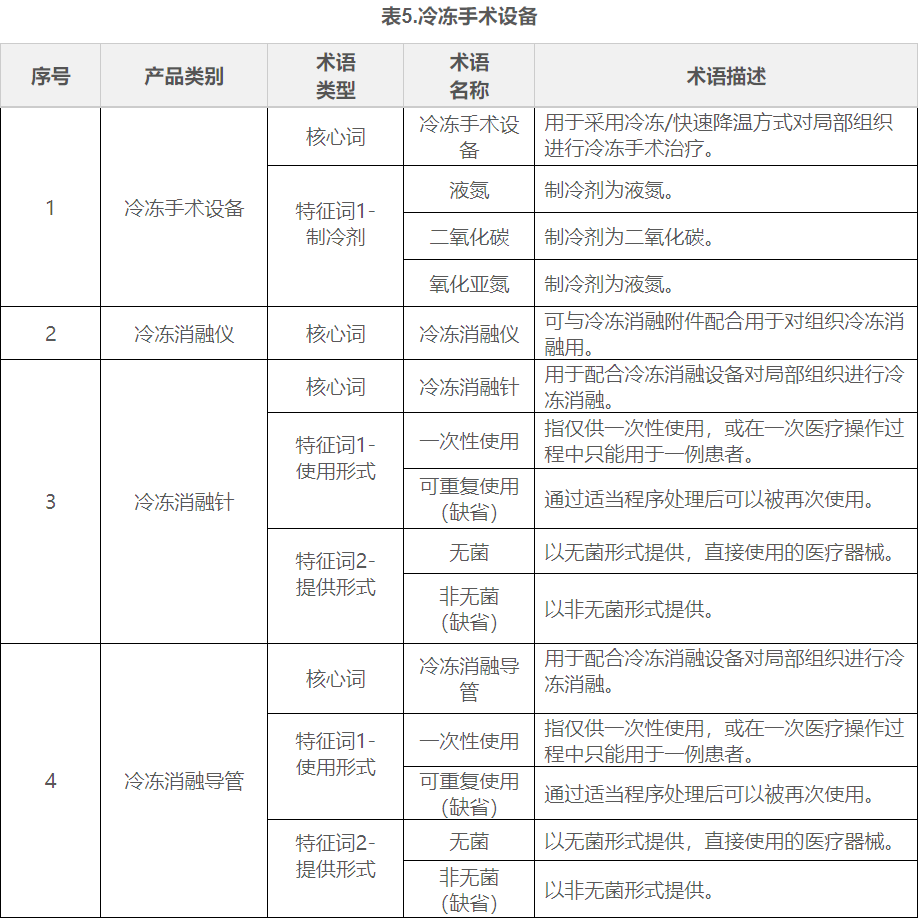
在表1到表9中,列举了有源手术器械领域典型产品的核心词和特征词的可选术语,并对其进行了描述。
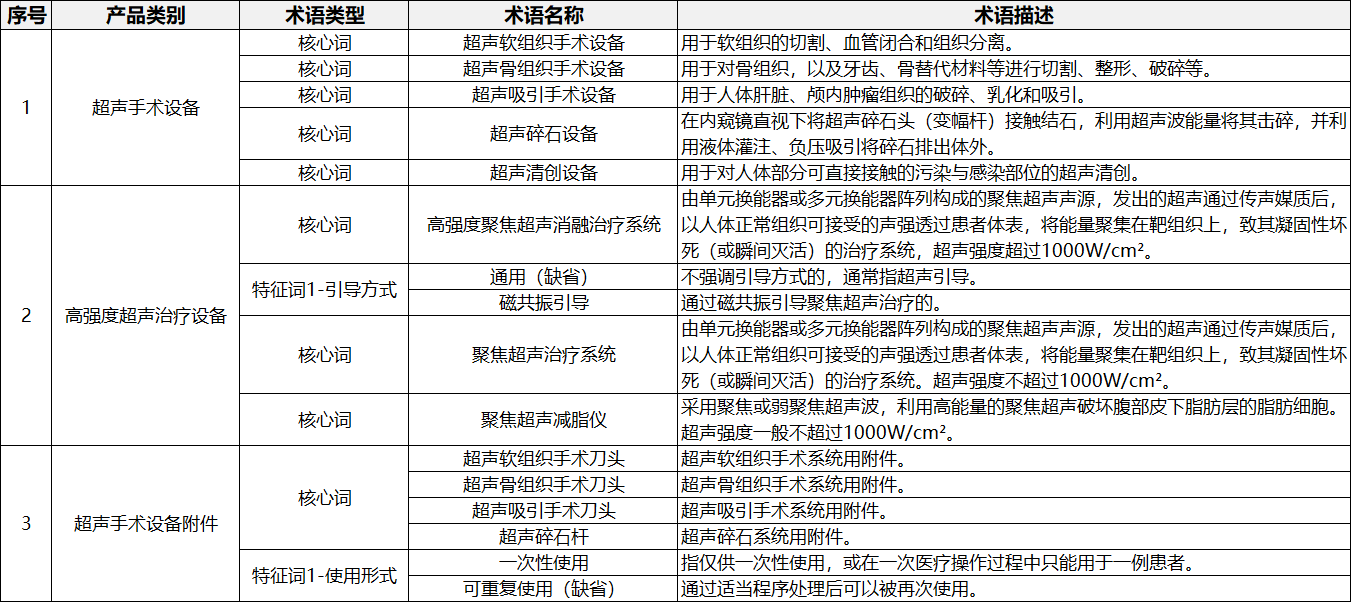 表3.高频/射频手术设备及附件
表3.高频/射频手术设备及附件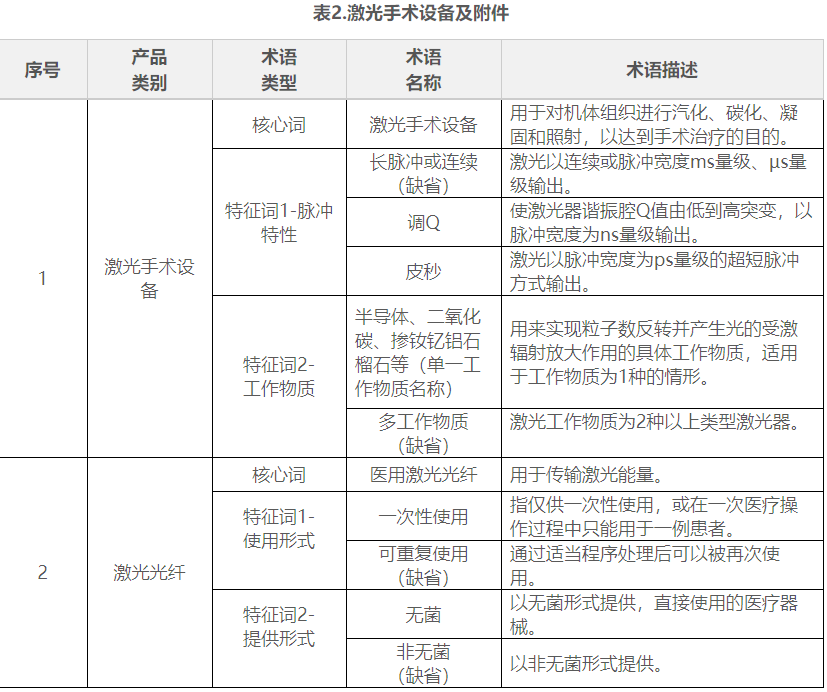
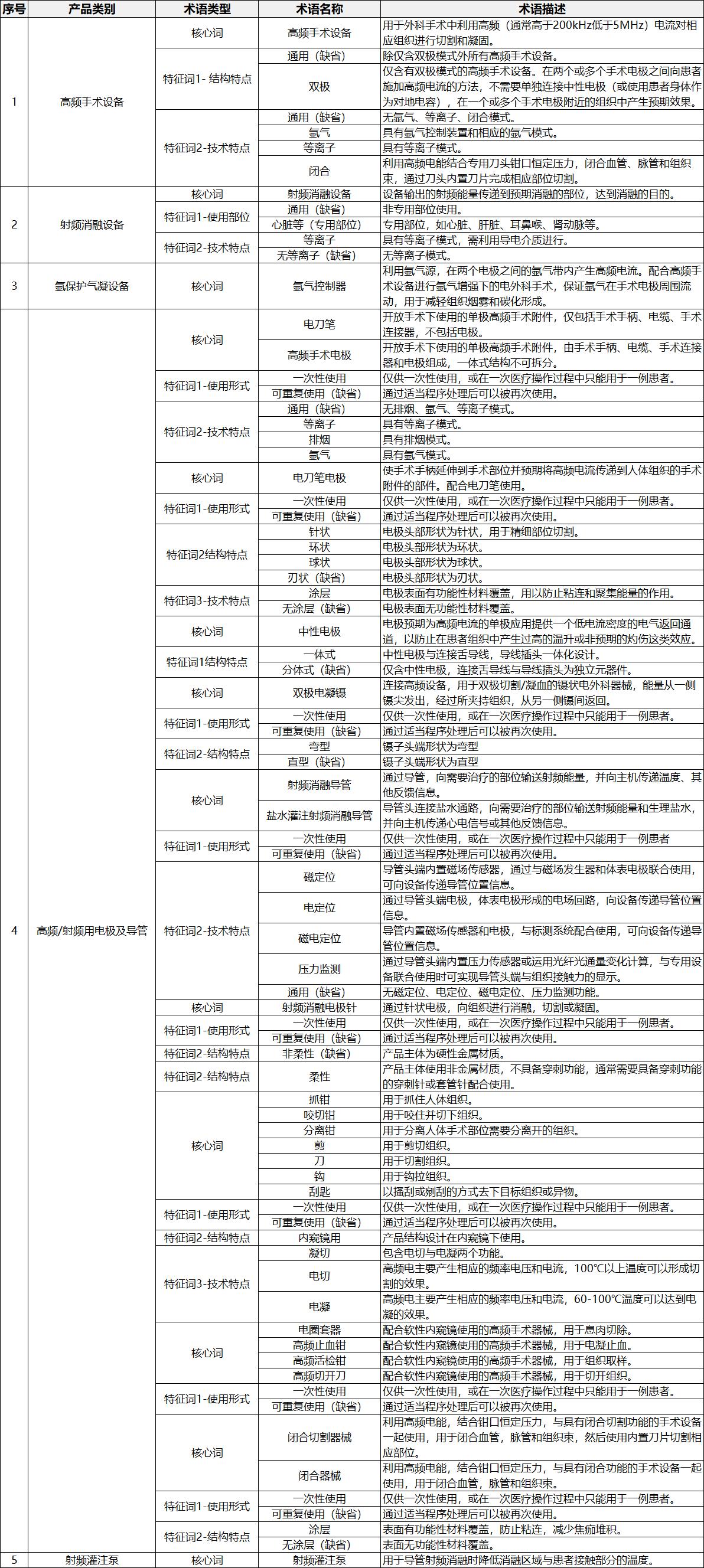 表4.微波手术设备
表4.微波手术设备
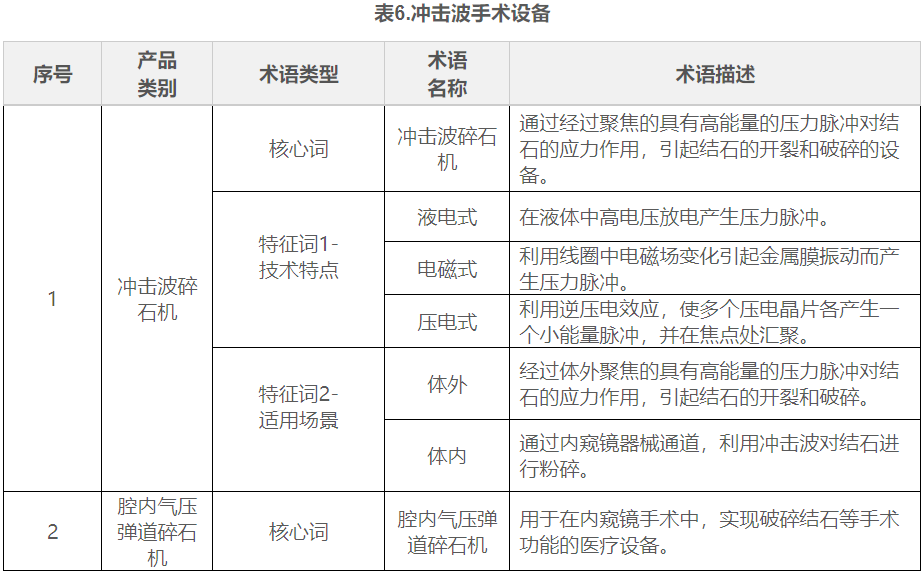
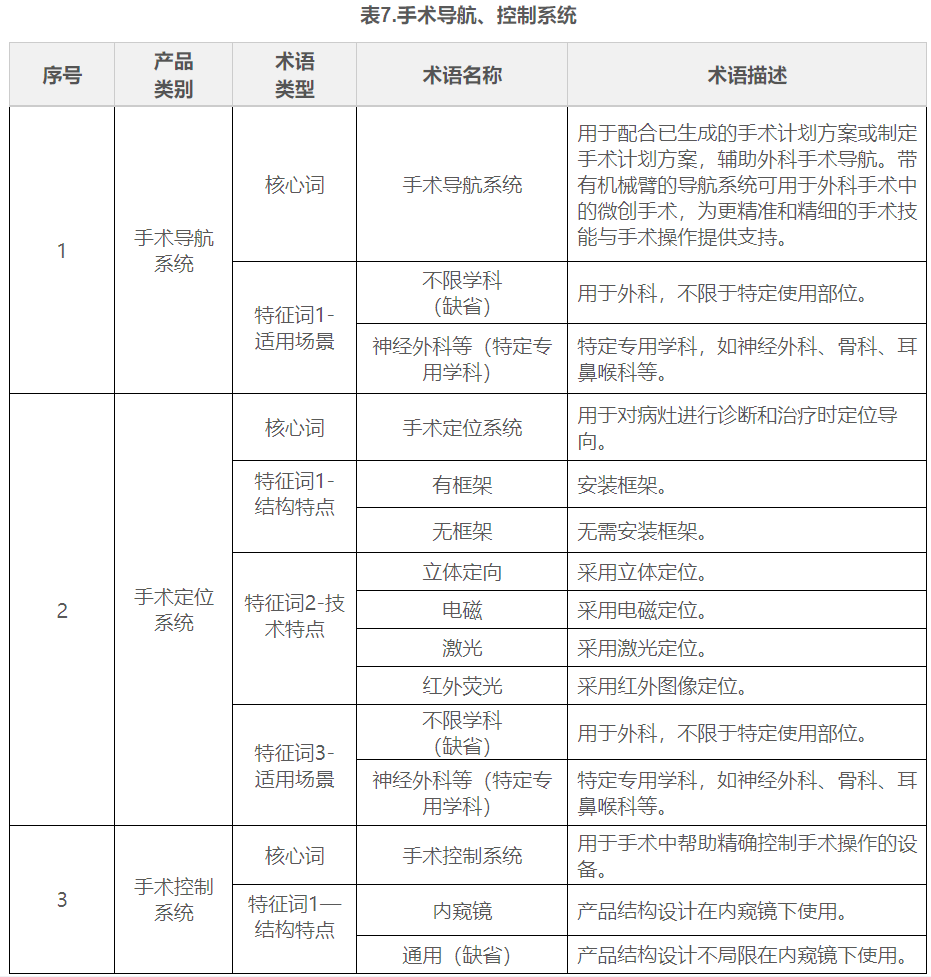
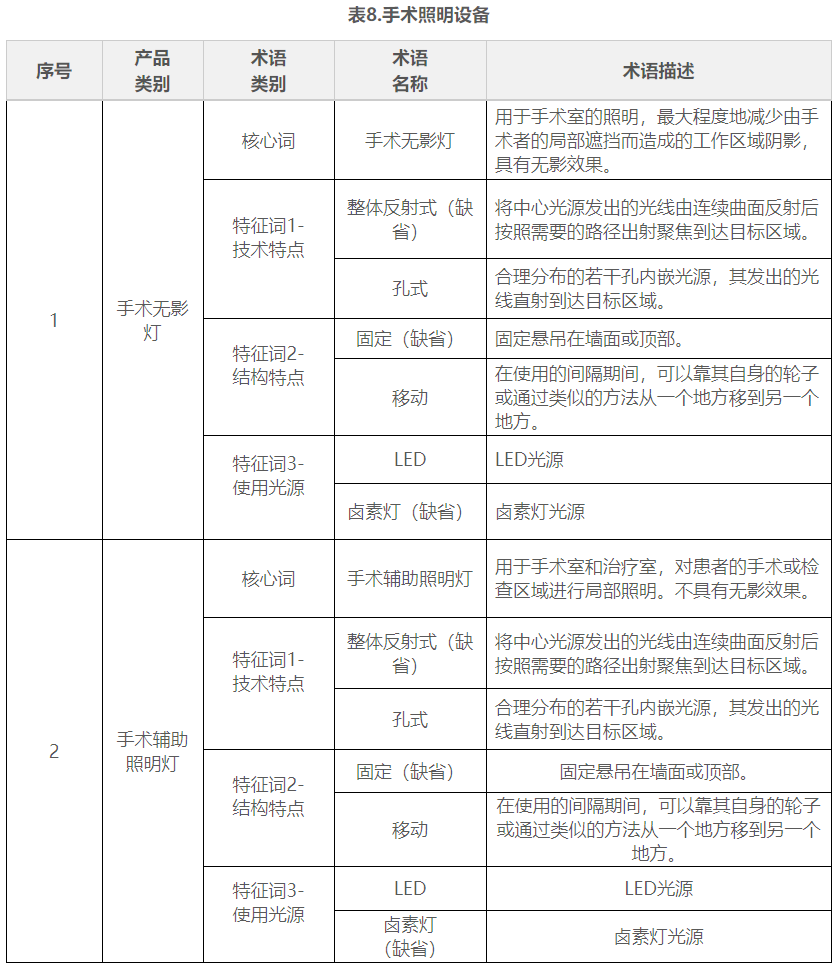
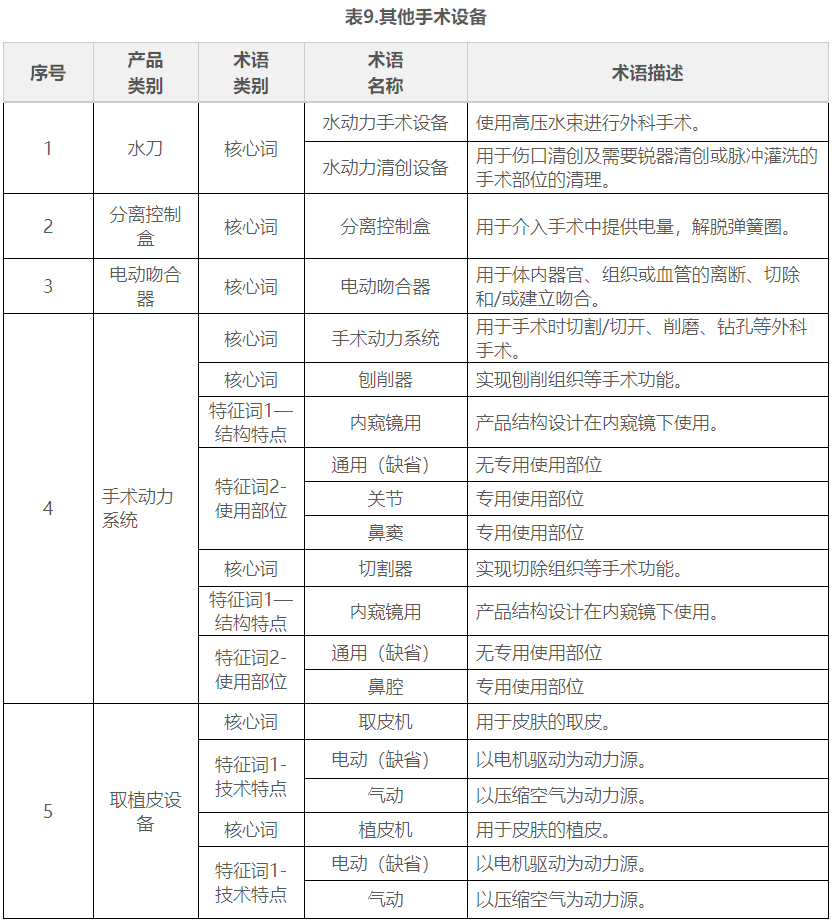
五.命名示例
参照表10至11命名示例,根据产品实际情况,选择对应子领域术语表,比对定义选择相应术语,按第三条第一款所述的结构顺序确定通用名称。
表10. 医用激光光纤
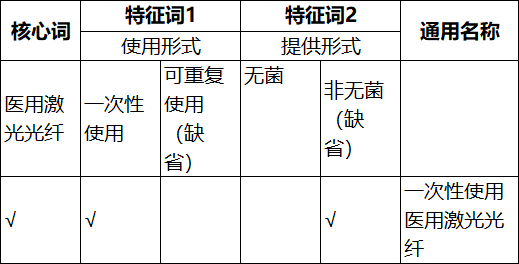
表11. 高频手术设备
[1] 国家食品药品监督管理总局关于发布医疗器械分类目录的公告(2017年第104号)
[5] Global Medical Device Nomenclature(GMDN)
[6] U.S. Food and Drug Administration. Product Classification Database
[7] Japanese Medical Device Nomenclature(JMDN)
本指导原则由国家药品监督管理局医疗器械标准管理中心编写并负责解释。
 表3.高频/射频手术设备及附件
表3.高频/射频手术设备及附件
 表4.微波手术设备
表4.微波手术设备





