近日,美国食品和药物管理局FDA已向强生公司的 Abiomed 与其 I Impella 心脏泵 I 级召回相关的警告信。理由是该公司未报告 Impella 心脏泵的质量问题,并且该设备使用的泵监控系统未获得上市前批准。
强生Abiomed发言人周三在一份电子邮件声明中表示,Impella 心脏泵仍留在市场上并可供患者使用。“我们正在与 FDA 密切合作,以尽快彻底解决观察结果。随着我们继续融入强生医疗科技,我们正在实施与观察结果相关的质量体系流程改进,其中许多纠正措施已经在进行中,”该发言人表示。
FDA 就 Impella 心脏泵问题,向强生 Abiomed 发出警告信
此外,在上个月的一封警告信中,监管机构指出了强生未能遵循几项质量管理程序和医疗器械报告要求,并称该公司未能遵循这些要求,导致今年早些时候召回了部分Impella 5.5 心脏泵。
Abiomed于 4 月份启动了对 466 台带有SmartAssist设备的 Impella 5.5 的召回 ,报告了与植入物相关的 179 起投诉、三人受伤,没有死亡,该植入物旨在短期接管心脏泵血职责。
FDA 在警告信中表示,尽管投诉率“高得令人无法接受”,然而 Abiomed 并未采取任何纠正或召回措施,直到该机构于 3 月 1 日至 4 月 13 日对该公司进行了最近一次检查。
这封信还指责 Abiomed 未能及时提交医疗设备报告,其中包含可能导致死亡或重伤的故障信息。FDA 指出,Abiomed 在 8 月份表示,对 254 份投诉记录的回顾性审查发现,“51 份记录被确定为需要产品历史审查”。
该机构表示:“您得出的结论是,进行的 51 项产品历史审查不需要采取额外行动或升级。”并补充说,没有提供任何记录来验证这一点。
Abiomed 周三表示,已向客户提供有关如何退回和更换召回设备的详细说明。该发言人补充说,最新版本的带有 SmartAssist 套件的 Impella 5.5 不包括在召回范围内,该套件预装了侧臂固定器和新的黄色接头。
该监管机构还针对名为 Impella Connect 的泵监控系统,该系统缺乏上市前批准或研究设备豁免。该机构表示,该监控系统的特点是“需要上市前授权的软件设备功能”。该系统允许用户远程监控泵的性能、查看案例信息并按警报状态过滤通知。
警告信称:“FDA 将评估贵公司提交的信息,并决定该产品是否可以合法销售。”
强生表示,Impella Connect 应用程序不会影响泵的功能,并且仍保留在市场上。强生发言人表示:“围绕软件设备功能的指导方针正在不断发展,我们致力于与该机构合作解决他们的意见。”
FDA 警告信并未涉及因泵与经导管主动脉瓣置换支架相互作用问题而引发的第二次 Impella 装置召回问题。6 月份,近 7,900 台心脏泵因该问题被召回,并导致四人死亡。这些设备仍留在医疗机构。
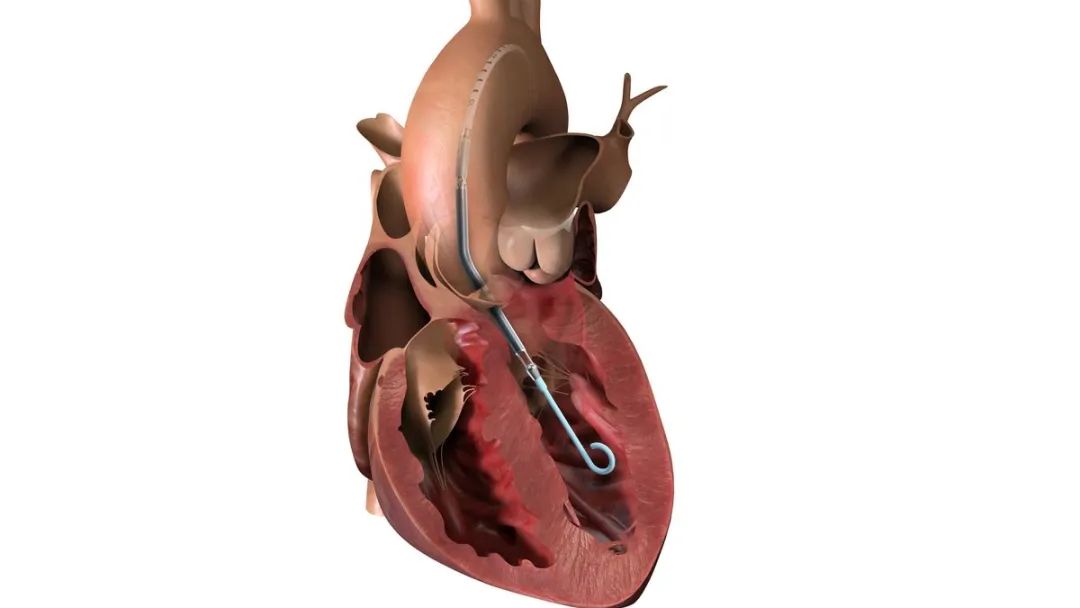
2023年6月5日,FDA发布了现场安全通知,将Abiomed Impella 5.5心脏泵的召回认定为一级召回,属于最严重的召回级别。起因是,Abiomed公司收到了该设备相关的客户投诉,涉及到泵的清洗侧壁上清洗液泄漏。
如果清洗液出现泄漏,设备将清洗压力过低,引发警报并需要评估。如果不加以解决,泄漏问题可能会导致泵停止运行,患者失去治疗。如果泵发生故障,处于危急状况的病人可能会进一步恶化,病情加重,甚至可能导致严重伤害或死亡。根据FDA的通知,Abiomed公司截止召回前报告了179起投诉,3起受伤,没有与这次召回有关的死亡。去年的一项研究发现,不属于最初批准组的患者死亡率很高,导致 Abiomed 缩小了在患者出现心力衰竭 48 小时后使用该设备的标签范围,该设备也面临审查。
丨Abiomed 心脏泵和 TAVR 支架之间的干扰导致四人死亡
2023年7月18日,强生旗下分公司 Abiomed 在短短几个月内第二次被 FDA 一级召回(Class I recall designation)。强生子公司 Abiomed 报告称, 该公司的 Impella 心脏泵和经导管主动脉瓣置换支架之间的相互作用导致 4 人死亡和 26 人受伤。
Abiomed 在发现 TAVR 支架可能损坏泵的电机后于 6 月开始召回其 Impella 系统。本月早些时候,FDA 将其归类为 I 级,即最高风险类别。
FDA 表示,此次召回包括美国境内的 7,895 台设备。
该机构强调,Impella 系统并未从医疗机构产品中移除。FDA 表示,医生可以继续在 TAVR 患者中使用该设备,但他们应该意识到潜在的相互作用并仔细放置它。
TAVR 植入物外缘的支架状支柱与 Impella 旋转的叶轮叶片接触后导致泵的部分叶片断裂。这种情况将导致两种后果,一,血流从Impella人工心脏的受损部位流出;二,受损的叶片碎片可能进入患者血液循环系统。而当TAVR的尺寸更大时,这种风险更高。
强生(J&J)去年 12 月完成了对 Abiomed 的 166 亿美元收购,加速进军快速增长的市场。该笔交易也成为2022年医疗科技行业最大的投资交易。此后,强生一直致力于将 Abiomed 整合到其心血管产品组合中,并在剥离其消费者健康部门后将其保留为强生医疗科技的一部分。随着强生收购Abiomed,在心血管领域尤其是在结构心领域强生又有了强大话语权。
当然目前Abiomed的Impella心脏泵能够强生带来销售额还是不多的,2021财年Impella系列产品销售额为8.06亿美元。即使加入强生后,或许短期内也无法改变强生落后于美敦力局面,但是Impella心脏泵后期潜力巨大(据相关数据预计到2028年能够实现超37亿美元销售额)。值得一提的是,中国百万级PCI手术量的市场,当前没有一台手术用到Impella心脏泵(在华没有获批上市)。而强生拥有了Impella心脏泵,进入中国这个最有潜力市场或将进一步打开中国市场。但前提是希望这款产品的上市销售之路不要一再遇挫。
Impella®心脏泵为FDA唯一获批,国产也有新突破
Impella®心脏泵是目前全球唯一获得美国FDA批准适用于需要高危PCI(经皮冠状动脉介入治疗)的严重冠状动脉疾病患者、急性心梗心源性休克治疗或右心衰竭的经皮心脏泵技术。这一技术与目前强生医疗科技的布局形成了强有力的补充,尤其在Biosense Webster心电生理领域,将进一步加速强生医疗科技向高增长市场转型。在2005年,Impella 也获得 CE 标志并在欧洲上市。
心力衰竭作为一种全球性疾病,影响了至少2600万人,且随着人口老龄化的发展,其患病率仍在持续上升,死亡和再住院率居高不下,已经成为了全球性的社会医疗卫生难题。
根据沙利文报告,全球心力衰竭市场的销售收入从2014年的35亿美元增长至2019年的55亿美元,年均复合增长率为9.4%。预计到2030年,市场销售收入将达到250亿美元。
尽管Abiomed现在垄断地位非常牢固,但是依旧有不少创新企业正在积聚力量挑战其霸权。其中不乏Puzzle Medical、CardiacBooster等等拥有独特技术创新挑战者。
而国产替代也在不断发力,其中今年8月23日,心擎医疗介入式人工心脏NyokAssist获得美国FDA“突破性设备”认定,这代表了该产品的创新性以及临床价值受到国际认可,也将加速其在美国的准入审批速度。
本次获得突破性认定的NyokAssist体积小于全球同类产品,且转速更低,减少创伤及血管等并发症风险。目前,该产品在猪体内测试成功,即将进入临床试验。
除高危PCI,心衰治疗也是介入人工心脏的广大蓝海,越来越多的国产心脏已从动物实验走向临床,可预见竞争将愈演愈烈。