心脏起搏器是一种有效治疗缓慢性心律失常的方法,全球每年植入起搏器的数量已超过125万例¹,并且这一数字还在持续稳定增长。尽管经过几十年的技术进步,关于最佳起搏部位和起搏模式仍存在着争议。
传统起搏器常采用右心室心尖起搏(Right Ventricular Apical Pacing, RVAP),因其操作简便、导线不易脱位和相对安全而广泛应用。然而,RVAP存在一些明显缺点,例如其激动顺序与正常生理性起搏激动顺序不同,导致电和机械不同步,增加了左心室功能不全、心衰再住院率、心房颤动和死亡率的风险²。此外,对于心力衰竭症状明显的患者,双心室起搏(Biventricular Pacing, BVP)的心脏再同步化治疗(Cardiac Resynchronization Therapy, CRT)也是一种治疗选择。CRT能促进左心室逆向重构,降低收缩性心力衰竭患者的住院率和死亡率。然而,CRT的双室起搏功能仅是对于正常心脏传导的一种模拟,临床上仍有一些患者对此治疗效果不佳的问题,而且CRT手术操作复杂且价格昂贵,大约有30%的患者术后无反应³。
近年来,无导线起搏器作为新兴产品备受关注。相较传统起搏器,无导线起搏器具有明显优势,其体积仅有胶囊大小,无需放置皮下囊袋和连接导线到心脏的过程,从而减少了相关的并发症风险。美敦力和雅培等制造商也纷纷推出了自己的无导线起搏器。而百多力的无导线起搏器也正在紧锣密鼓地研发中,希望能解决目前临床上存在的一些限制问题。
然而,目前市场上的无导线起搏器仍然存在一些不可避免的限制。
首先,由于适应证狭窄,无导线起搏器并不适用于所有患者。其次,价格较高,且电池寿命较短,需要更频繁地更换设备,且无真实的心房感知能力。此外,长期无法取出也是一个值得关注的问题,这可能会对患者后续治疗带来一定挑战。另外,目前国内使用的无导线心脏起搏器仅能勾挂在右室心间部位,这实际上是一种非生理性的起搏模式,与正常心脏放电传导的路径不同,严格来说是逆向传导。长期在右室心间部位起搏可能会带来一系列问题,如心室扩张、心室不同步收缩、心室晚收缩等⁴。
因此,在无导线起搏器的发展过程中,仍需克服上述限制,并进行更加深入的研究,以提高其适用范围和治疗效果,最终为患者带来更多益处。同时,持续改进传统起搏器技术和探索其他创新治疗手段也是至关重要的方向,以进一步提升心脏起搏器治疗在临床上的效果和安全性。
随着心脏起搏器治疗的发展,寻求最佳的生理性起搏方式成为当前研究的热点。希氏-浦肯野系统(希浦系统)起搏,也被称为传导系统起搏(Conduction System Pacing, CSP),涵盖希氏束起搏(His-bundle pacing, HBP)和左束支区域起搏(Left Bundle Branch Area Pacing, LBBaP)。这一方法只需通过一根电极连接到心脏自身的传导系统上,从而纠正束支传导阻滞,恢复心室收缩同步性,实现最接近生理状态的电传导。
CSP采用一根电极即可代替左右心室两根起搏电极的作用,直接激动人体的希氏-浦肯野传导系统,实现最接近生理状态的心脏电传导。然而,HBP手术目前面临一些挑战,其中手术成功率较低且操作难度较大。由于HIS束位于室间隔的膜部,存在耗电和电极易脱位等缺点。因此,目前CSP手术以LBBaP居多。LBBaP作为新兴的起搏方式,术后可明显改善患者左心室的电机械同步性,且远期左心室收缩功能明显优于RVSP。此外,LBBaP还避免了右心室起搏的相关并发症。多项研究证实了HBP的可行性和有效性⁵,然而LBBaP在术后效果上表现出更大的潜力。
CSP作为一种追求更加生理性的心脏起搏方式,在临床上具有广泛的应用前景。它不仅可以改善心室的电机械同步性,减少不同步收缩带来的不良影响,还可以避免传统起搏方式可能引发的一系列并发症。LBBaP作为新兴的起搏方式正逐渐得到关注,其更低的手术风险和更优越的术后效果使其成为CSP手术的主要选择。
在2023年4月15日,欧洲心脏病学会(ESC)杂志《Europace》发布了一份国际共识声明:关于CSP手术操作的最安全、最有效的方法。该共识声明由欧洲心律协会(EHRA,ESC的一个分支机构)制定,并得到亚太心律协会(APHRS)、加拿大心律协会(CHRS)和拉丁美洲心律协会(LAHRS)的背书。这一共识声明在2023 EHRA期间的EHRA传导系统起搏峰会上一经发布,就引起了临床领域的高度关注。
瑞士日内瓦大学医院的Haran Burri教授作为该共识的第一作者,对CSP手术的前景进行了展望。他指出:“据估计,在2023年,全球每年将有140万患者接受起搏器,其中大约一半可能会从CSP中受益。CSP连接到人体自身的电流通路中,因此比传统方法更具生理性。” CSP作为一种更加生理性的起搏方式,能够直接激活心脏固有传导系统的不同部位,使心脏实现同时收缩,从而避免了标准起搏可能导致的心脏不同区域的不协调收缩。Burri教授强调,约五分之一的患者因此损伤心脏并导致心力衰竭,而CSP手术的出现为这些患者提供了一种更加安全有效的治疗选择。
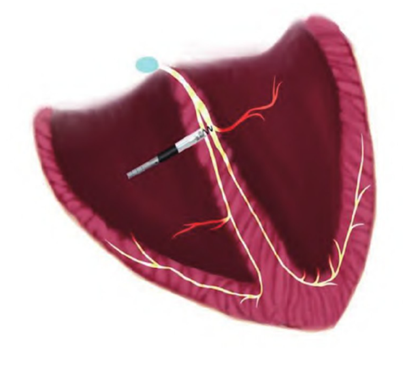
生理性起搏示意图: 显示直接连接到人体自身传导系统,是最符合生理的起搏位点。
随着共识声明的发布,传导系统起搏正在逐步进入主流临床实践。尽管目前数据还相对有限,但该疗法展现出光明的未来。然而,为确保CSP手术的安全有效进行,医生必须采取标准化方法。此次国际共识的制定将为临床医生提供统一的操作指南,从而确保患者能够获得最佳的治疗效果。
综合而言,CSP手术作为一项具有前瞻性和创新性的治疗手段,已成为国际医学界的研究热点,并在全球范围内推动着心脏起搏器治疗的发展趋势。通过共识声明的发布,CSP手术将为更多患者带来希望,并在未来继续受到更多科学研究和临床实践的关注,以进一步完善该疗法并为患者提供更优质的医疗服务。
EHRA关于传导系统起搏植入的临床共识声明: 确认LBBaP的传导系统捕获流程⁶
CSP手术工具:
百多力 vs 美敦力,寻找最适选择
目前国内进行传导系统起搏(CSP)手术的厂家主要有两家,分别是百多力和美敦力。这两家公司采用不同类型的CSP工具,也代表了市场上两种不同的CSP工具。
美敦力作为最早推出CSP工具的厂家,其3830电极和C315鞘在CSP手术中使用最为广泛。作为相对成熟的CSP工具,美敦力的产品具有以下优势:首先,3830主动固定导线无钢丝支撑,直径仅有4.1F,是市场上最细的电极之一。最初为儿童起搏而研发,后来广泛用于CSP起搏。其细小设计有助于减少对锁骨下区域的压迫,降低囊袋负担。其次,C315鞘管同样相对细长,具有好的柔韧性
为了优化临床手术工具,百多力推出了采用钢丝支撑导线的CSP工具。这种钢丝支撑电极通过连接钢丝提供更好的支撑性,特别适用于植入LBBaP的心肌区域,并具有以下优势:首先,操作相对简单,适合初学者使用。结合百多力的Selectra 3D鞘和Solia S钢丝支撑电极,手术更加轻松顺利。研究显示,使用百多力的CSP工具可以实现较高的手术成功率,起搏参数稳定,且并发症发生率较低。其次,钢丝支撑有助于提高手术成功率⁷。通过连接钢丝,医生可以进行单极测试,准确确定起搏阻抗,并生成与连接pin类似的起搏QRS波形和感知电图,实现连续起搏和监测阻抗及起搏波形。这为安全、成功地进行LBBaP植入提供了有力支持。
在比利时的8家中心(包括大中心和小中心),共有353名患者使用百多力Solia S导线行LBBaP手术,平均成功率高达96%。
百多力的支撑鞘Selectra 3D在设计之初,充分考虑来自全球13个国家的23位HBP专家顾问委员会的建议。其具有良好的支撑性能,相比其他厂家的鞘管,不易弯折,并且在国内市场上提供了两种长度和三种弯曲形状的共六种选择,以满足不同心脏解剖的需求。这使得医生在进行CSP手术时能够更加灵活和准确地选择合适的工具,从而提高手术的成功率和效率。


对于这两种不同类型的CSP工具,EHRA的专家共识指出各自有其优势和劣势,而并不倾向于任何一种类型的导线。根据具体情况和患者的需求,医生可以选择合适的工具,以实现最佳的手术效果和患者康复。在不断的技术发展和临床实践中,CSP手术将持续受到关注,并为心脏起搏治疗带来更多的创新和改进。
传导系统起搏,尤其是左束支起搏,是当前心脏起搏领域最为生理性和创新的治疗方式,它成功弥补了传统右室起搏、希氏束起搏和双室起搏的一些不足之处。CSP的独特优势在于其能够改善血流动力学参数,从而让患者获得长期的临床益处。作为目前起搏领域的研究热点,CSP技术正不断随着技术的进步和临床研究的深入逐步完善,并为符合适应证的患者带来更多的临床获益。
目前市场上的CSP工具主要由百多力和美敦力两家厂家主导,它们采用不同类型的CSP工具,各有各自的优势。随着技术的不断发展和进步,CSP起搏术将会迎来更广阔的发展前景。特别是借助新型的钢丝支撑导线等创新技术,预计更多的医生将熟练掌握CSP手术技术,为患者提供更加生理性的起搏治疗,有效改善心衰预后,提高患者的生活质量。
在市场大局中,CSP技术已经成为国际起搏治疗的趋势,得到欧洲心脏病学会等专业组织的支持和认可。随着CSP技术的不断完善和应用的拓展,传导系统起搏有望成为心脏起搏治疗的重要发展方向,为患者带来更好的治疗效果和健康福祉。在未来,我们可以期待CSP技术的不断创新和优化,为更多患者带来希望,并推动心脏起搏领域的进一步进步与发展。
1. Carrión-Camacho, M Reyes, et al. "Safety of Permanent Pacemaker Implantation: A Prospective Study." J Clin Med, vol. 8, no. 1, 2019, p. 35.
2. Liu P, Wang Q, Sun H, et al. Left Bundle Branch Pacing: Current Knowledge and Future Prospects[J]. Front Cardiovasc Med, 2021.
3. Nakai T, Ikeya Y, Kogawa R, et al. Cardiac resynchronization therapy: Current status and near-future prospects[J]. J Cardiol, 2022, 79(3): 3.
4. Raatikainen M.J.P., Arnar D.O., Merkely B., Nielsen J.C., Hindricks G., Heidbuchel H., Camm J.A. Decade of Information on the Use of Cardiac Implantable Electronic Devices and Interventional Electrophysiological Procedures in the European Society of Cardiology Countries: 2017 Report from the European Heart Rhythm Association. EP Europace.
5. Stanley A, Jr., Athanasuleas C, Buckberg G. How His bundle pacing prevents and reverses heart failure induced by right ventricular pacing[J]. Heart Fail Rev, 2021, 26(6): 1311-1324.
2017;19:ii1–ii90. doi: 10.1093/europace/eux258.
6. Burri H et al. EHRA clinical consensus statement on conduction system pacing implantation: Europace. 2023 Apr 15; 25(4):1208-1236. doi: 10.1093/europace/euad043.
7. De Pooter et al. J Cardiovasc Electrophysiol.2022. DOI: 10.1111/jce.15558.