为进一步规范基因测序仪临床评价等申报资料的管理,国家药监局器审中心组织制定了《基因测序仪临床评价注册审查指导原则》等3项指导原则,现予发布。
特此通告。
附件:1.基因测序仪临床评价注册审查指导原则
国家药品监督管理局
医疗器械技术审评中心
2022年11月22日
本文为附件1:
基因测序仪临床评价注册审查指导原则
本指导原则旨在指导注册申请人对基因测序仪注册申报资料的准备及撰写,同时也为技术审评部门提供参考。
本指导原则是对基因测序仪的一般要求,申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由并提供相应的科学依据,同时依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定,随着法规和标准的不断完善,以及科学技术的不断发展,相关内容也将适时进行调整。
一、适用范围
本指导原则适用于高通量测序的基因测序仪采用通过同品种医疗器械临床数据或通过自身临床试验数据进行临床评价。
目前高通量基因测序技术即指第二代测序技术或下一代测序(Next Generation Sequencing 或NGS)技术,其技术特征是:(1)通过测定单元的高度并行化来实现高通量;(2)由于化学、物理等原理的限制,序列读长较短,一般在150~300bp(个别原理可以实现>600bp,比如焦磷酸测序法);(3)核心技术成熟。使用元件(比如Flow Cell、硅基阵列、微流控电导结构等)的加工技术(一般在微米尺度以上)技术成熟,器件结构和性能稳定。其化学原理主要包括DNA聚合酶循环测序法和DNA连接酶循环测序法(单色或多色荧光底物标记),如基于聚合酶的联合探针锚定聚合法、基于底物特征的可逆末端终止法,以及基于电学原理和光学原理的焦磷酸测序方案等。基于其他技术的基因测序仪产品,可参照本指导原则相关适用条款并结合产品特点准备注册申报资料。
本指导原则适用于申请产品注册和相关变更注册的产品。
申请人应当按照《医疗器械临床评价技术指导原则》的要求,选择通过同品种医疗器械临床数据或者临床试验这两种评价路径中适用的任一方式提交临床评价资料。
二、临床评价资料
(一)同品种临床评价路径的基本要求
1.同品种医疗器械判定
申请人可按照《医疗器械临床评价技术指导原则》中“同品种医疗器械”的定义和判定,选择已在境内获准注册的对比器械,根据申报产品特征选择合适的对比项目,分析对比器械是否符合同品种医疗器械的要求。
申请人所选取的同品种医疗器械应与申报产品适用范围相同,基本原理相同,关键功能模块构成相同、性能相似,关键指标没有显著差异。
2.申报产品与对比器械的等同性论证
选择合适的对比器械后,应进行相关项目的对比以论证其等同性。对比项目包括但不限于附件1所列举的项目。对比内容包括定性和定量数据、验证和确认结果,应详述二者的相同性和差异性,对于相同性,应提交充分的证据(如产品说明书、审评报告、检验报告、技术要求等)并明确证据来源。对差异性是否对产品的安全有效性产生不利影响,应通过申报产品自身的数据进行验证和/或确认。
对比申报产品和同品种产品在适用范围的相同性和差异性,建议重点考虑可检测的核酸类型、变异类型以及对使用环境的要求。
基本原理应重点关注生化原理(包括但不限于酶学反应、信号发生、信号源强度等)、物理原理(包括但不限于信号采集部件、光源、滤光器件等)、碱基对序列判断和质量评估原理(包括但不限于碱基对序列判断算法、核心数据集、错误率评估、系统弱点评估等)、系统集成原理和性能(包括但不限于:系统结构、核心模块、系统操控软件、操控人需求、可靠性等)等原理和基本性能等。
对于结构及功能模块,建议结合图示标注及性能参数进行对比。
关键指标应重点关注数据质量(包含所测序列中每个碱基的准确度:一般为仪器或分析软件系统的碱基判定时特有的质量值)、一次运行的数据产量(包括平均产量、最大产量、在不同质量阈值下的平均产量等)、测序在一定质量阈值下的平均读长(可包括高质量的最长读长和最短可用读长等)、仪器指定的不同测序模式、不同测序模式产生的数据量和运行时间差异等。
根据上述比较,如对比产品不符合同品种产品要求的,应重新选择对比产品进行同品种比较或补充申报产品的临床试验资料;如申报产品与对比器械可判定为同品种产品,还需对两者之间的差异进行阐述并对是否对产品安全性、有效性产生不利影响进行进一步评价。相关内容可参考《医疗器械临床评价等同性论证技术指导原则》。
3.差异性部分的安全有效性证据
针对申报产品与对比器械之间的差异,注册申请人需提交充分的科学证据证明二者的安全有效性等同。
科学证据包括但不限于:差异对下个模块性能或步骤的影响研究,差异对数据质量的影响研究。通常为研究资料或验证报告等。科学证据应详细说明针对差异进行的研究方式及研究结果,通常需包括准确、可靠、完整、可追溯的数据,必要时包括数据的产生过程,试验数据建议来自有良好质量控制的实验室;应进一步评价差异是否影响性能,以及影响的程度和范围,必要时提供临床试验数据进行确认。
不同情形所需提交的支持性资料不尽相同,申请人应当根据具体差异点提供相应的支持性资料,资料的类型和数量应根据申报产品和对比产品的差异点对产品安全性、有效性的影响进行确定。具体内容可参考表1,表1中具体情况举例可能不能涵盖所有情况,申请人应根据申报产品的具体情况进行列举和判定,并给出判定的具体理由。
表1 申报产品与对比产品关系及需提交资料类型表
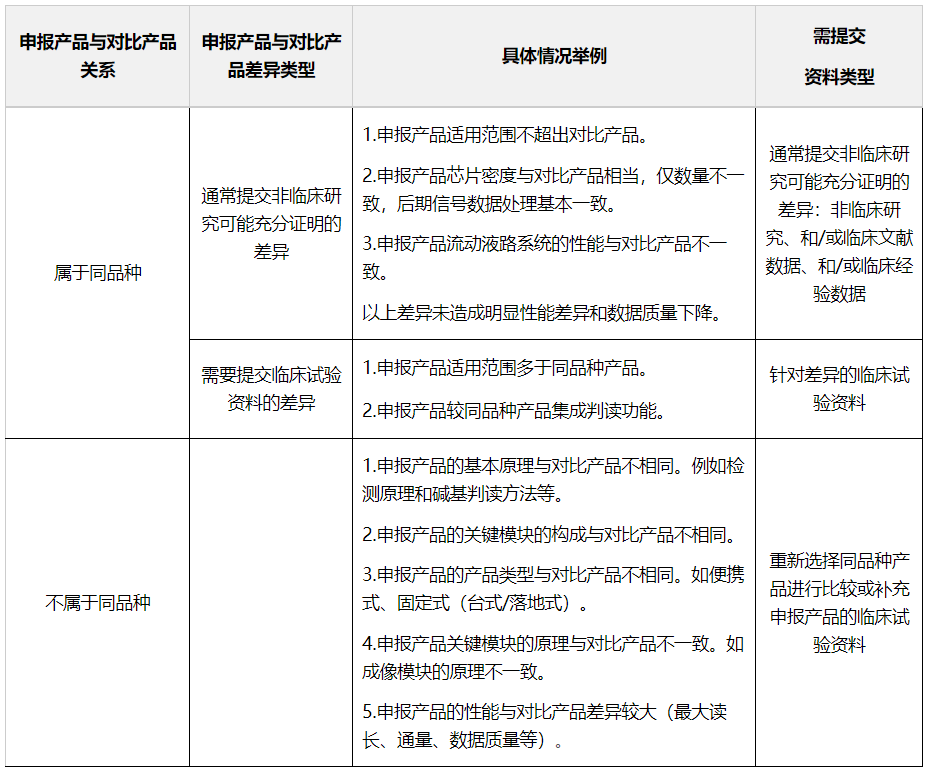
对于较同品种产品增加的适用范围,应提交申报产品针对差异性的临床试验数据作为支持性资料。
对于存在多个差异点的情况,申请人应当完整地列出申报产品与同品种基因测序仪的所有差异点,并说明这些差异点的相互关系。若不同差异点之间存在相关性或相互影响,则应提供单个差异点影响的研究证据和关联性差异点共存时影响的研究证据。
基于申报产品和同品种基因测序仪的对比结果,如果非临床研究、临床文献数据、临床经验数据等无法充分地证明该差异对产品安全性和有效性的影响,则申请人应提供相应的临床试验资料。
通过对相应的性能及数据质量的评价,结果显示没有显著差异的,可认为申报产品与同品种产品基本等同。则可收集同品种产品的临床数据集,以证明申报产品自身的安全有效性。
4.同品种医疗器械的临床数据总结
如果判定申报产品与对比器械基本等同,则可收集同品种医疗器械的临床数据集,以证明申报产品的安全有效性。同品种医疗器械临床数据的收集、同品种医疗器械临床数据分析评价方法、临床评价报告撰写等方面的具体内容可参照《医疗器械临床评价技术指导原则》及《医疗器械注册申报临床评价报告技术指导原则》的相关规定。
对于同品种产品在临床应用时产生的安全有效性数据,应考虑选择不同变异类型、不同核酸类型的临床检测项目及数据质量。
(二)临床试验路径的基本要求
临床试验的开展、方案的制定以及报告的撰写均应符合相关法规、指导原则的要求,如相关法规、指导原则有更新,临床试验应符合更新后的要求。下面仅说明该类产品临床试验中应关注的重点问题。
1.临床试验机构
应选择不少于两家(含两家)符合要求的临床试验机构开展临床试验。临床试验机构应具备相应的检测资质和人员。
2.临床试验目的及设计
(1)临床试验目的
通过试验医疗器械与临床参考方法或已上市同类产品进行比较研究,确认试验医疗器械的安全性、临床性能和/或有效性。
(2)对比方法的选择
对于已有同类产品上市的临床研究,可以选择临床参考方法或已在中国境内上市的同类产品作为对照。如选同类产品作为对照,建议选择目前在临床检测方面使用状况良好的机型,应注意试验医疗器械的适用范围不应超过同类产品的适用范围,同时应提供对照产品的信息,如生产企业、型号、适用范围等。如试验医疗器械的适用范围超过已批准上市同类产品,可在以同类产品作为对照对相同的适用范围进行评价的同时,另外选择临床参考方法作为对比方法,对超出同类产品的适用范围进行临床评价。
对于无同类已上市产品的临床研究,可选择临床参考方法作为对比方法进行比较研究,以评价试验医疗器械的临床性能。
临床试验中还应对试验医疗器械和对比方法检测结果不一致样本进行分析,以明确结果不一致的原因。
(3)研究项目的选择
如试验医疗器械的适用范围为对来源于人体样本的人脱氧核糖核酸(DNA)进行测序,以检测基因序列变化,至少应选择人类基因靶向测序以及非靶向测序项目进行评价。其中人类基因靶向测序,建议选择肿瘤组织的基因突变为对象,应包括代表性的突变类型,至少包括点突变、小片段的插入/缺失、拷贝数变化;非靶向测序项目可选择胎儿染色体非整倍体检测。如适用范围还包括核糖核酸(RNA)的测序,即将RNA逆转录成DNA后进行测序,则还应对基因融合(如ALK融合)进行验证。
如试验医疗器械的适用范围不限于人DNA,应充分考虑产品适用的临床预期用途选择合适的代表性项目进行评价。
应根据试验医疗器械所声称的适用范围,选择代表性的检测项目进行临床评价,同时应考虑到不同样本类型。应根据临床试验中所选择的临床项目,制定受试者的选择标准,即入选和排除标准。同时受试者年龄、性别分布应均衡合理,充分考虑人种、地域差异对试验结果的影响。同时选择代表性的临床项目时,应考虑避免偏倚,试验过程中应注意盲法。
(4)临床评价指标
主要评价指标一般为检测准确性(灵敏度、特异度)或检测一致性(阳性/阴性符合率、总符合率、Kappa值等),主要评价指标应能够满足评价产品临床性能的要求。
同时申请人还应对临床试验检测项目进行数据质量的分析。
次要评价指标一般包括仪器功能、稳定性、使用便捷性、使用安全性等。
(5)样本量估算
为实现抽样样本代替总体的目的,临床试验需要一定的受试者数量(样本量)。样本量一般以临床试验的主要评价指标进行估算。需在临床试验方案中说明样本量估算的相关要素及其确定依据、样本量的具体计算方法。主要评价指标的相关参数根据已有临床数据和探索性性试验(如有)的结果来估算,需要在临床试验方案中明确这些估计值的确定依据。一般情况下,Ⅰ类错误概率α设定为双侧0.05或单侧0.025,Ⅱ类错误概率β设定为不大于0.2,预期受试者脱落和方案违背的比例不大于0.2,申请人可根据产品特征和试验设计的具体情形采用不同的取值,需充分论证其合理性。
如临床试验采用试验医疗器械与已上市同类产品进行比较研究的试验设计,建议采用单组目标值法样本量公式估算最低样本量。
公式中,n为样本量;Z1-α/2、Z1-β为显著性水平和把握度的标准正态分布的分数位,P0为评价指标的临床可接受标准,PT为试验用体外诊断试剂评价指标预期值。
对于所选择进行临床验证的代表性项目大类,如人类基因靶向测序,总样本量应满足统计学要求,其中每种代表性的突变类型均应有一定例数。对于病原体检测,每一个代表项目的总样本量应满足统计学要求。
(6)统计分析
应选择合适的统计方法对临床试验结果进行统计分析,对于试验医疗器械与参考方法/已上市同类产品的一致性评价,一般选择2×2四格表的形式总结两种产品的检测结果,并据此计算灵敏度/特异度、阳性/阴性符合率、Kappa值等指标及其95%置信区间。
对于不一致样本,应进行原因分析。如临床试验方案规定采用其他方法进行确认,则确认结果不应纳入统计分析。
对于临床试验检测项目的数据质量的分析,应至少包括原始数据质量以及用于判读的数据质量,进行整体数据分析和分层统计。应关注数据质量的独立评价和相互的可比性,明确每运行最大和最小数据量、有效数据和仪器设定阈值、碱基质量评估方法和软件等。整体数据分析通常关注数据量、碱基识别质量值、高质量数据与总体粗数据产出的比例、靶区域总体覆盖度和均一性、根据背景序列GC含量不同的覆盖差异、比对质量值等指标。分层统计应结合项目具体要求,统计相应指标在不同数据指标水平下的样本分布。对数据质量较低的样本数据进行原因的分析和解释。
对于次要评价指标,仪器功能一般主要分析仪器运行过程中是否能实时监测运行状态并自动对用户进行提示、异常状态报警功能、运行过程追踪记录功能、数据备份功能、样本/反应载体/试剂正确识别功能等;稳定性主要分析仪器在临床试验过程中可持续正常工作;使用便捷性主要分析试验参数设置的便捷性及操作界面友好性等;使用安全性主要包括机械安全性、电气安全性、噪声安全性、生物安全性等。
3.质量控制
临床试验开始前,建议进行临床试验的培训,以熟悉并掌握相关试验方法的操作、仪器、技术性能等,最大限度控制试验误差。整个试验过程都应处于有效的质量控制下,最大限度保证试验数据的准确性及可重复性。
三、决策是否开展医疗器械临床试验
对于具有下列情形之一的产品,通过同品种医疗器械临床数据进行分析评价无法充分证明产品安全性、有效性的,应当进行临床试验,包括:
1.申报产品或其某关键模块(含软件)具有全新的技术特性,或者数据质量具有显著差异。
2.申报产品具有新的临床预期使用场景和功能,且该功能从未在境内获得批准。
3.针对与同品种医疗器械之间的差异,若不能通过非临床研究数据、临床应用数据等证据资料证明申报产品的安全性和有效性,申请人需要考虑通过临床试验来获得临床数据。
具体决策是否开展医疗器械临床试验可参照《决策是否开展医疗器械临床试验技术指导原则》,并提供充分的依据。
四、参考文献
[1]医疗器械临床评价技术指导原则[Z]
[2]医疗器械临床试验质量管理规范[Z]
[3]医疗器械临床试验设计指导原则[Z]
[4]医疗器械临床评价等同性论证技术指导原则[Z]
[5]决策是否开展医疗器械临床试验技术指导原则[Z]
[6]医疗器械注册申报临床评价报告技术指导原则[Z]
[7]YY/T 1723高通量基因测序仪[S]
附件:申报产品与同品种基因测序仪对比表
附件
申报产品与同品种基因测序仪对比表
1. 适用范围
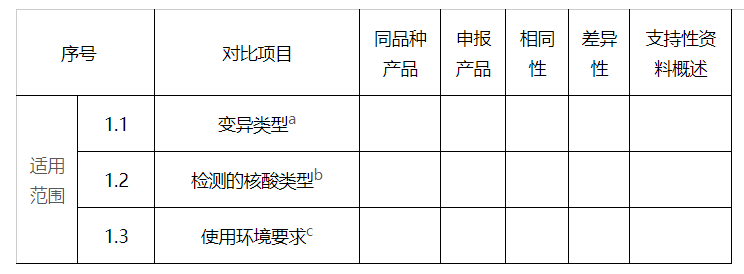
a变异类型通常包括点突变、插入/缺失、拷贝数变异等变异类型。
b检测的核酸样本类型通常包括人类基因组DNA、细胞内RNA、细胞外循环DNA或RNA,病原体DNA或RNA等。
c使用环境要求包括温湿度、洁净程度等环境条件。
2.基本原理
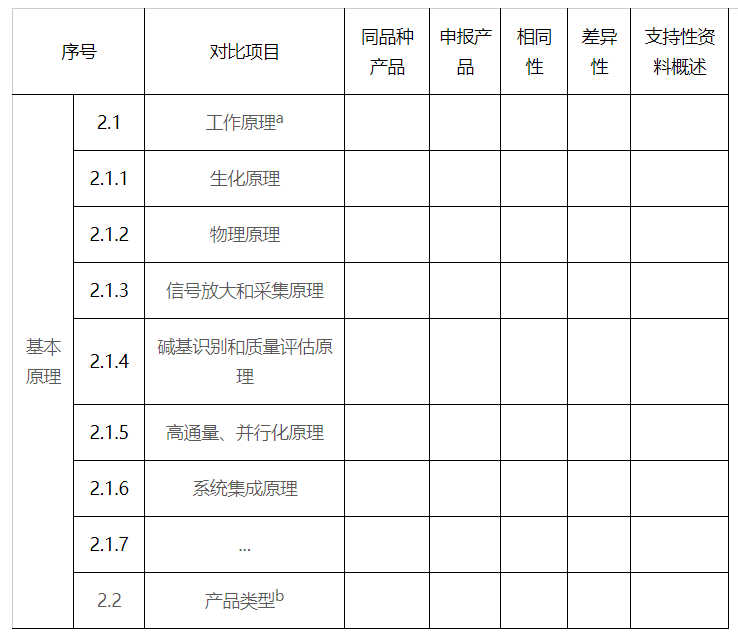
a申报产品和同品种产品的工作原理应一致。应详述核心结构模块的原理,包括:生化原理(包括催化酶、底物标记、荧光化学、试剂保存、芯片表面处理等)、物理原理(光学或电学模块并行化、信号采集、液路设计、废液收集处理等)、碱基判断和质量评估原理(包括信号处理、质量评估等核心算法和软件来源)、系统集成原理等。
b产品类型应明确便携式、固定式(台式/落地式)。
3.结构组成
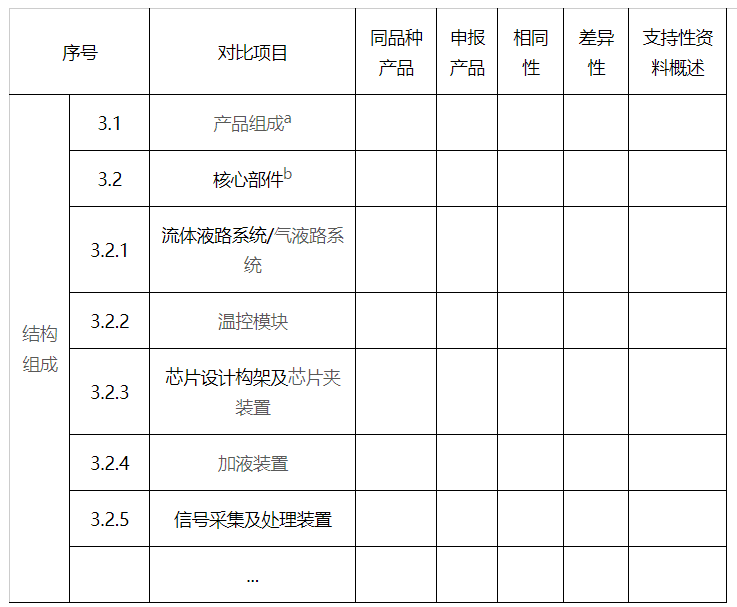
a产品组成应包括描述申报产品的所有结构组成。对成像模块、流动槽支架、流体自动化模块、缓冲剂吸管装置等功能模块进行逐项详细比对。结构及模块建议进行图示和标注。
b核心部件应至少对加样装置、温控模块、芯片(包括材质、结构、密度)、信号采集(光学或非光学信号采集的关键器件)和处理装置及其元件技术指标进行对比。
4.性能要求
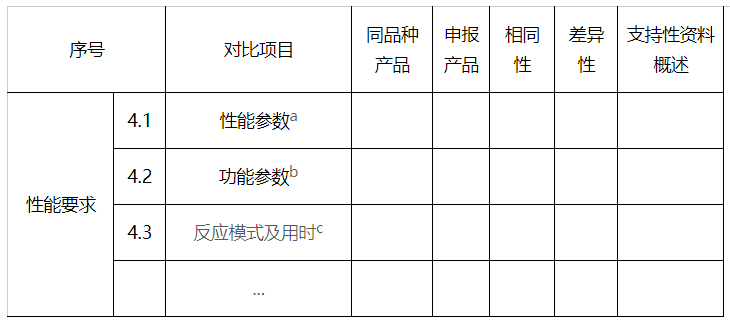
a性能参数应包括不同模块的具体参数比较。
b功能参数应包括最大数据量/run,最大reads长度,平均读长(带有质量参数的读长),突变类型以及人与病原体的检测性能(包括适用样本类型,变异类型,检测核酸样本类型的比较),并对数据质量进行充分评价。应包括一定数据量的情况下有效数据量和数据质量,以及可稳定检测的最大循环数比较。
c反应模式及时间应包括所有的反应模式,如PE150,PE250,SE35等。
5.软件核心功能及算法

6.配套要求
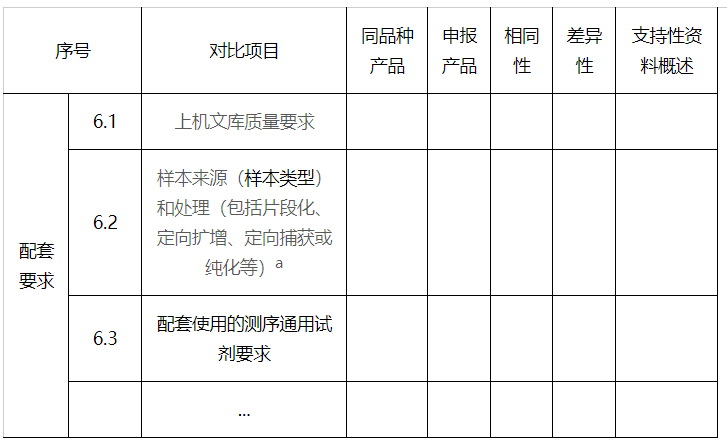
a样本类型通常包括血清、全血、组织、FFPE及其他含有人类以及各种病原体的核酸的样本类型等,可采用代表性样本类型(根据样本中基因组特征)。
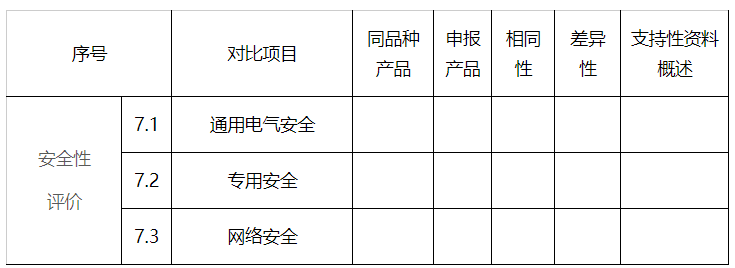
7.安全性评价
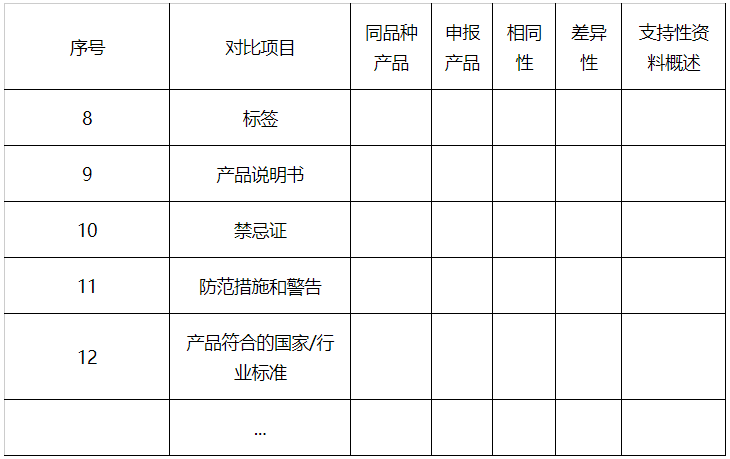
8.其他
以上所列出的内容为申报产品与同品种基因测序仪对比需要具体考虑的事项,申请人可根据产品特点增加对比项目。