国家药监局于9月9日印发了《国家药监局综合司关于加强医疗器械生产经营分级监管工作的指导意见》,公布了《国家药监局医疗器械生产重点监管品种目录》。为落实相关法规要求,加强医疗器械生产监管,科学合理配置监管资源,市药监局组织对《北京市重点监管医疗器械目录(2015年版)》进行修订,结合我市医疗器械监管工作实际,形成《北京市医疗器械生产重点监管品种目录(征求意见稿)》,现向社会公开征求意见,欢迎社会各界提出意见建议。
公开征集意见时间为:2022年9月20日至9月30日
意见反馈渠道如下:
1.电子邮件:qxscc@yjj.beijing.gov.cn,邮件主题请注明“北京医疗器械生产重点目录反馈意见”。
2.邮寄通讯地址:北京市西城区枣林前街70号中环广场A座1302室,北京市药品监督管理局医疗器械生产监管处,邮编100053。
3.电话:010-83979531
4.传真:010-83560730
5.登录北京市人民政府网站(http://www.beijing.gov.cn),在“政民互动”版块下的“政策性文件意见征集”专栏中提出意见。
附件:1.《北京市医疗器械生产重点监管品种目录(征求意见稿)》
2.《北京市医疗器械生产重点监管品种目录(征求意见稿)》修订说明
3.《征求意见反馈表》
北京市药品监督管理局
2022年9月20日
附件1:
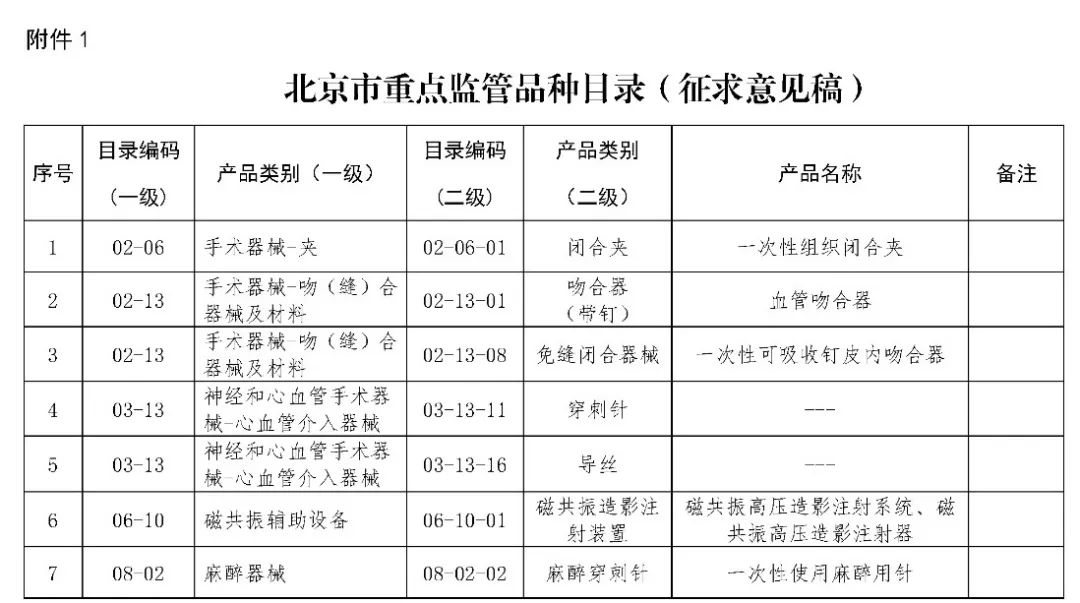
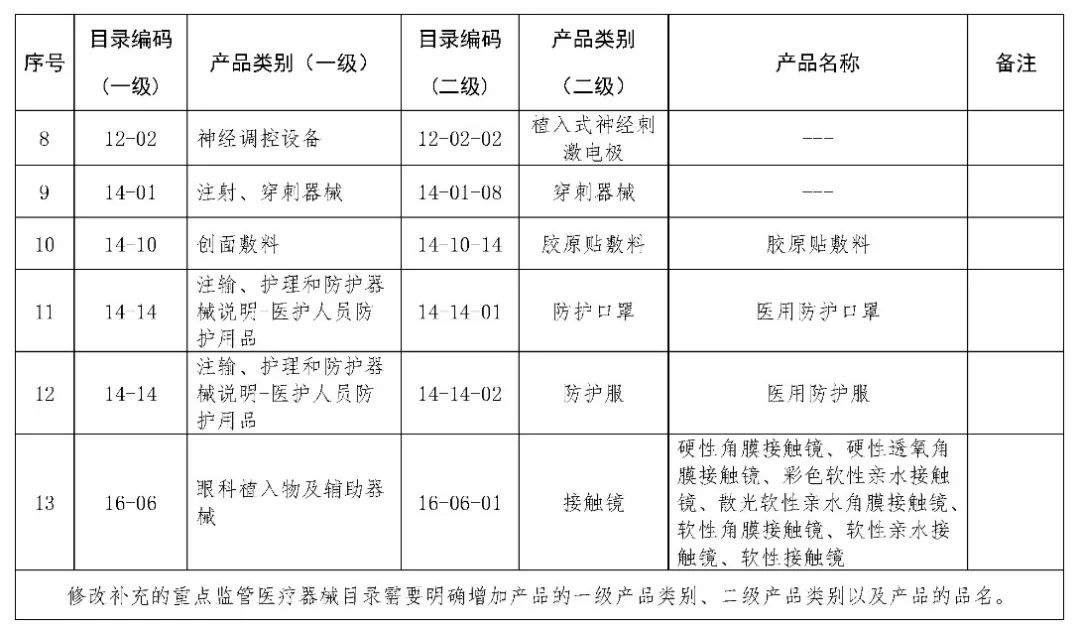
北京市医疗器械生产重点监管品种目录(征求意见稿)
附件2
《北京市医疗器械生产重点监管品种目录(征求意见稿)》修订说明
2022年5月1日新修订发布的《医疗器械生产监督管理办法》规定:国家药品监督管理局组织制定重点监管产品目录。省、自治区、直辖市药品监督管理部门结合实际确定本行政区域重点监管产品目录。
2022年9月9日,国家药监局印发了《国家药监局综合司关于加强医疗器械生产经营分级监管工作的指导意见》,公布了《国家药监局医疗器械生产重点监管品种目录》。
为落实相关法规要求,加强医疗器械生产监管,科学合理配置监管资源,市药监局组织对《北京市重点监管医疗器械目录(2015年版)》进行修订,结合我市医疗器械监管工作实际,形成《北京市医疗器械生产重点监管品种目录(征求意见稿)》。
在修订过程中,市药监局高度重视,组织多部门监管人员成立修订工作组,多次就修订工作召开研讨会,并深入医疗器械生产企业开展调研,充分结合本市医疗器械生产企业特点和监管工作实际需求,严格按照《医疗器械监督管理条例》及配套规章文件要求逐条研究进行修订,现向社会公开征求意见。
《医疗器械监督管理条例》(中华人民共和国国务院令第739号)、《医疗器械生产监督管理办法》(国家市场监督管理总局令第53号)、《国家药监局综合司关于加强医疗器械生产经营分级监管工作的指导意见》(药监综械管〔2022〕78号)。
(一)对目录格式进行修订。按2018年医疗器械分类目录和体外诊断试剂分类目录体例,按照分类目录逐类别进行归纳,便于日常监管使用。
(二)结合近年来北京市医疗器械生产监管工作实际,按照国家药监局相关工作要求,将部分高风险创新医疗器械,以及量大面广、易引发舆情风险的产品纳入北京市医疗器械生产重点监管品种目录。
(三)深入贯彻国务院深化放管服改革精神,移除了原重点监管目录中以现有生产质量控制水平来看风险较低的产品,如计划生育用医疗器械的避孕套、宫内节育器等医疗器械,坚持放管结合,放管并重。