受理号:JQZ2100255
医疗器械产品注册技术审评报告
产品英文(原文)名称:
Shockwave Peripheral Intravascular Lithotripsy (IVL) Catheter
申请人名称:Shockwave Medical, Inc.
一、申请人名称
Shockwave Medical, Inc.
二、申请人住所
5403 Betsy Ross Drive Santa Clara,CA USA 95054
三、生产地址
5403 Betsy Ross Drive Santa Clara,CA USA 95054
技术审评概述
产品由发生器、连接器电缆、输液架支架、充电模块及电源线组成。
该产品在医疗机构使用,与本公司生产的一次性使用冠脉血管内冲击波导管、一次性使用外周血管内冲击波导管配合,用于对血管内钙化病变进行预处理及球囊扩张。产品适应证以配合使用导管所批准的适用范围为准,可配用导管型号见产品技术要求附录。
该产品为用于血管内冲击波治疗的能量发生器,预期与本公司生产的一次性使用外周/冠脉血管内冲击波导管配合使用,用于对外周或冠脉血管钙化病变进行处理和扩张。
该产品基于体外碎石冲击波原理改进而来,将聚焦式高强度能量改为发散式低强度能量,为血管内导管提供能量以产生冲击波对钙化病变部位进行松解,从而缓解血管狭窄程度或便于后续治疗。目前尚无同样原理和使用方式的产品在我国获准注册。
产品发生器为内部电源设备,需充电使用,通过连接器电缆与血管内冲击波导管相连,连接部位采用磁吸方式进行固定。设备内部软件可识别导管型号,并自动设定相应输出脉冲序列和脉冲个数。不同导管的单脉冲输出能量相同,单次脉冲数和可用脉冲总数存在差异,使用者不能对输出参数和输出个数进行调节,仅可控制启动输出。设备还可判断导管是否已使用,以及记录并存储当前激发脉冲数。
申请人提供了产品性能研究资料以及产品技术要求的研究和编制说明,给出了能量输出参数、连接力、识别功能、电气安全和电磁兼容等功能性、安全性指标以及与质量控制相关的其他指标的确定依据。产品技术要求中各指标参考了相关的国家、行业标准,包括:GB 9706.1-2007、YY 0505-2012。
产品使用期限为3年,申请人通过分析各关键部件的使用寿命,并对整机可输出脉冲总数进行测试,验证产品可耐受的脉冲输出总数和累计使用时间,并按照实际使用频率换算可等效为3年。同时提供了电池使用寿命的验证资料,验证电池可满足预设使用期限内的充放电次数,并且在使用末期的电量仍能满足预设临床使用需求。
申请人按照《医疗器械软件注册技术审查指导原则》的要求,提交了软件描述文档。产品含3个不同的独立软件模块,分别给出了相应的技术资料和版本信息,各软件模块版本与总版本号关联。发布版本号为02.23。产品不含数据交互功能,不涉及网络安全研究。
申请人提供了产品在猪体内模型中开展的慢性动物试验对照研究资料,评价产品将冲击波能量输送到外周动脉/冠状动脉的安全性和血管效应。分别配合外周和冠脉导管模拟临床使用情况进行血管内冲击波治疗,使用不同导管的最大可耐受能量对不同部位的血管进行试验,治疗后随访28天。结果显示,全部动物均存活至随访期末,治疗过程中未出现并发症,各治疗部位影像学检查未发现明确管腔狭窄或血流不畅,病理学检查显示治疗部位组织和正常组织形态相似,动物体征健康。
申请人提供了基于外周/冠脉各个不同系列导管的冲击波声压能量分布研究测试报告。模拟实际临床使用状态,使用1:1混合液在规定气压条件下充盈球囊,分别测试不同导管的输出特性,测量并计算每个单一波源在球囊界面方向上的声压传输范围,以及所有波源能量叠加后的覆盖区域。结果证实产品冲击波能量范围和强度可涵盖预期治疗部位。
产品符合医用电气相关通用安全标准(GB 9706.1-2007)和并列安全标准(YY 0505-2012)的要求,提供由医疗器械检验机构出具的符合标准要求的检验报告。
该产品与一次性使用冠脉血管内冲击波导管或一次性使用外周血管内冲击波导管配合使用,申请人针对不同配合使用的导管进行了临床评价。
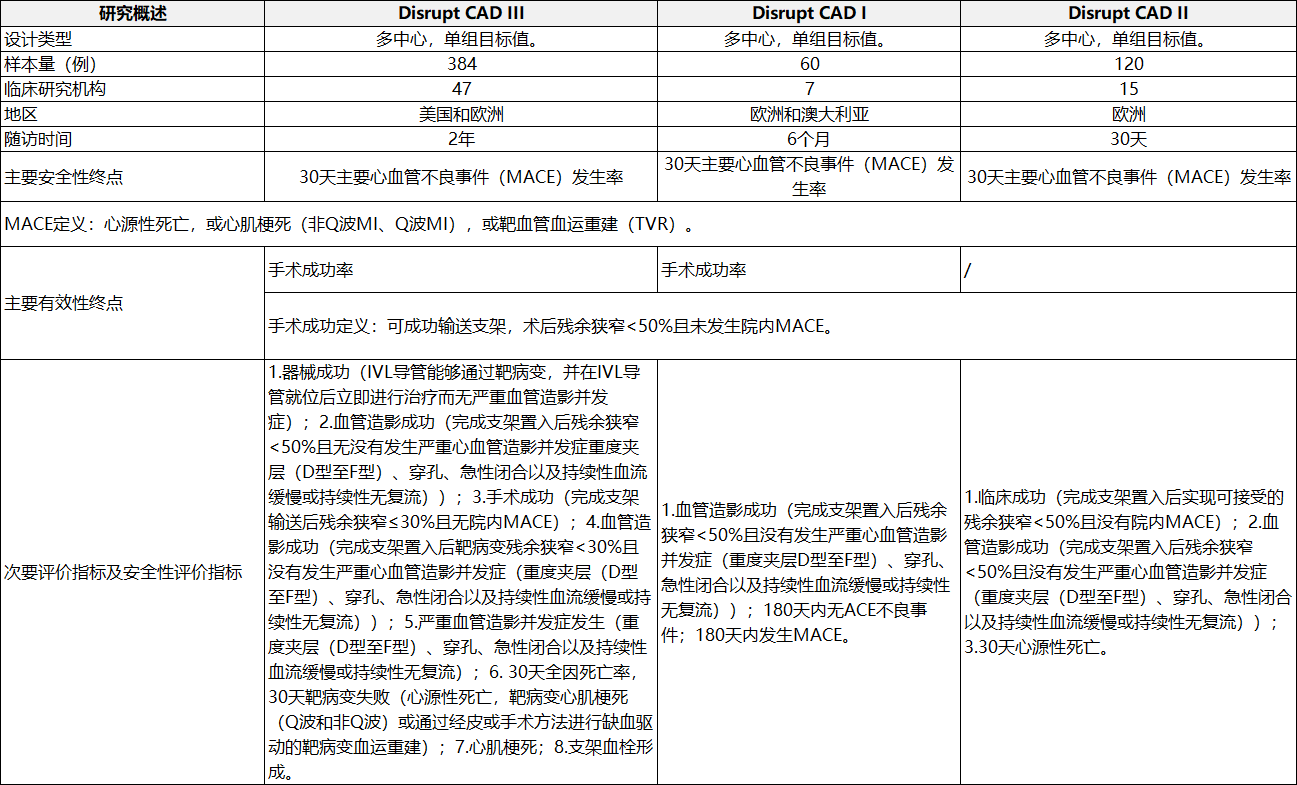
申请人采用临床试验路径进行临床评价,提交了境外临床试验数据。临床试验目的为评价一次性使用冠脉血管内冲击波导管在支架置入前用于治疗冠状动脉钙化病变的安全性与有效性。提交的临床数据包括Disrupt CAD I、II、III,其中Disrupt CAD III为IDE研究,Disrupt CAD I为上市前临床试验,Disrupt CAD II为欧洲上市后临床研究。
表1冠脉临床研究概况
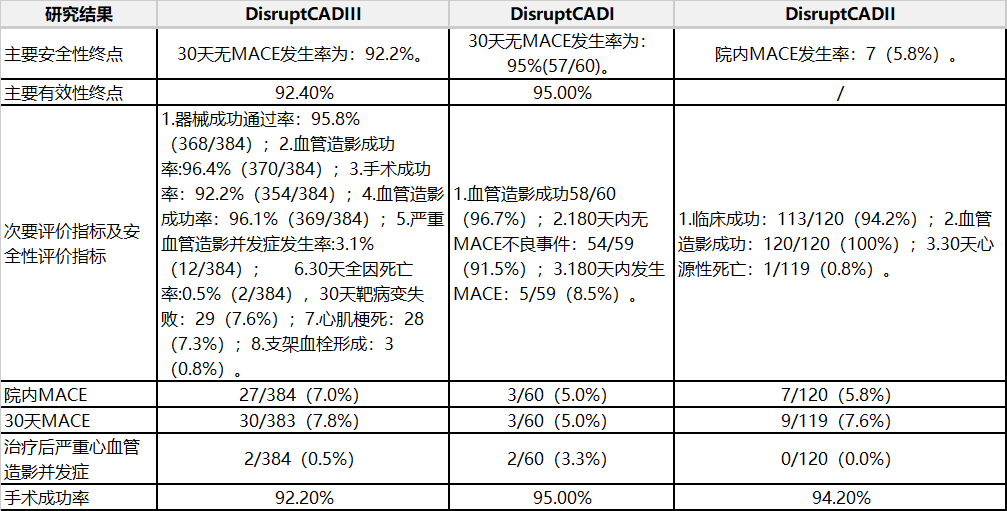
表2冠脉临床研究结果2.冠脉临床研究结果(见表2)。
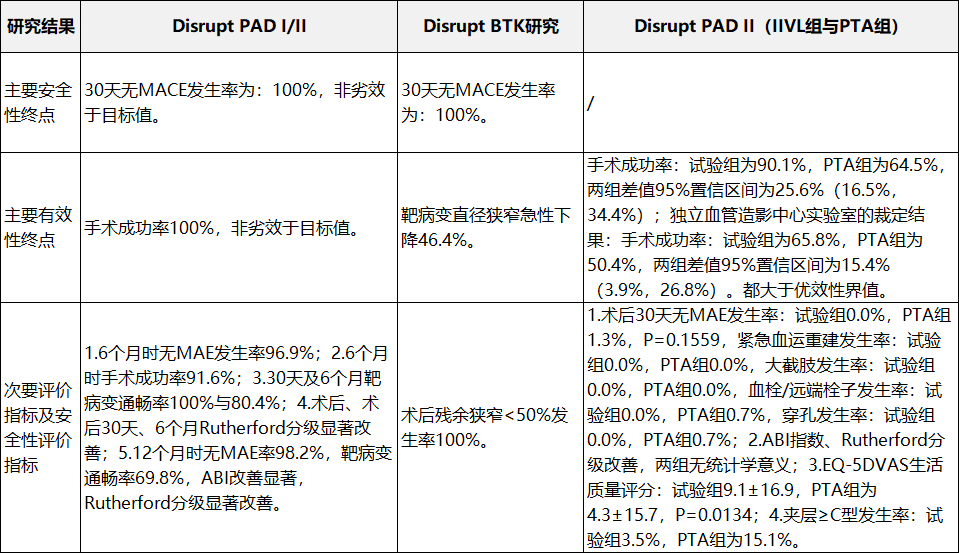
申请人采用临床试验路径进行临床评价,提交了境外临床试验数据。临床试验目的为评价一次性使用外周血管内冲击波导管用于治疗下肢动脉钙化病变的安全性与有效性。提交的临床数据包括Disrupt PAD I、II、III,以及Disrupt BTK研究,其中Disrupt PAD I/II、Disrupt BTK上市前临床试验,Disrupt PAD III为美国上市后临床研究。(二)一次性使用外周血管内冲击波导管配合使用
表3外周临床研究概况
表4外周临床研究结果2.外周临床研究结果(见表4)。
四、产品受益风险判定此外,还提供了Disrupt PAD III临床研究中的BTK亚组数据(共101例患者),病变基线及临床试验结果与Disrupt PAD BTK临床研究基本一致。
该产品用于成人患者对外周血管钙化病变或原发性冠状动脉钙化病变进行预处理及球囊扩张,主要受益是为患者提供了一种额外的钙化病变处理手段。主要风险为临床使用时的手术相关风险,特别是冲击波可能导致的钙化斑块脱落风险,以及不必要的使用或者操作不当等。
根据申请人提供的申报资料,经综合评价,在目前认知水平上,认为该产品的上市为适用人群带来的受益大于风险。
综合评价意见
该产品为首个申报的同类医疗器械产品。依据《医疗器械监督管理条例》(国务院令第680号)、《医疗器械注册管理办法》(原国家食品药品监督管理总局令第4号)等相关医疗器械法规与配套规章,经对申请人提交的注册申报资料进行系统评价,申报产品符合安全性、有效性的要求,符合现有认知水平,建议准予注册。
2022年5月6日