2022年3月11日,国家卫健委官网,国务院应对新型冠状病毒肺炎联防联控机制综合组印发《关于印发新冠病毒抗原检测应用方案(试行)的通知》(以下简称《方案》)显示,经研究,决定在核酸检测基础上,增加抗原检测作为补充。
消息一出,业内热度高涨。据此前中泰研报数据显示,参考海外政策,按照最低最低频率假设每月2次,预计国内新冠抗原年市场规模将达到2124-3192亿元。
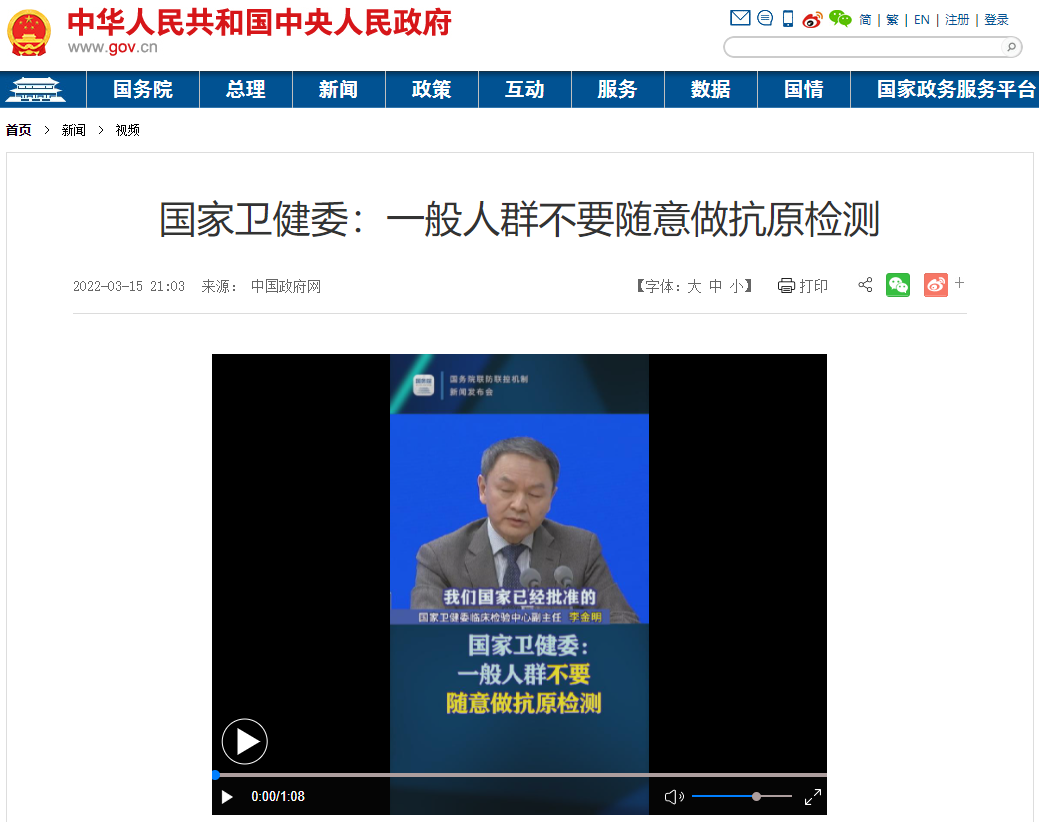
不过,业内热情尚未维持几天,3月15日下午,国务院联防联控机制举行新闻发布会。明确传达出一个信号:一般人群不要随意做抗原检测。
千亿新冠抗原检测试剂市场瞬间被打回原形。
国家定调:使用场景确认
在国务院联防联控机制举办的新闻发布会上,国家卫健委临床检验中心副主任李金明确认了抗原检测的适用人群及使用场景。
一、到基层医疗机构就诊,发生临床症状5天之内的人员,核酸检测为阴性后,可以居家连续检测5天抗原,持续为阴性的则无需干预。
二、隔离观察的人员,包括居家隔离观察、境外入境人员,以及出现出现散发疫情时的密接、次密接以及封控小区的足不出户的人员。
三、居民中希望自己做检测的人员。
受益于我国前期对疫情的严格防控,我国大部分地区人群的流行率低于百万分之一,而目前我国已经批准的抗原检测试剂敏感性在75%-98%,特异性在95%-99%之间,如果在一个千万级别的城市使用抗原检测做筛查,将会得到30万个阳性,其中只有9个是真的。
因此,抗原检测应当适用于高风险、高流行率的聚集性感染的人群检测中。一般人群不要随意做抗原检测。
多家企业获批,集采降价启动
自3月11日《方案》通过后,3月12日,国家药监局连夜审批据,南京诺唯赞、北京金沃夫、深圳华大因源、广州万孚生物、北京华科泰生物的新冠病毒抗原检测试剂盒应用申请变更获得批准。自此5款新冠抗原自测产品正式上市。
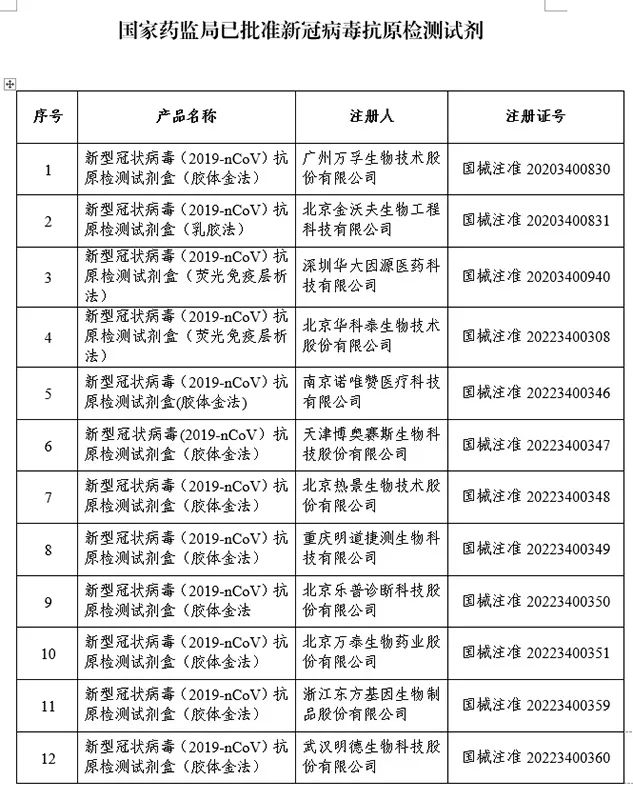
截至3月16日,国家药监局已批准12个新冠病毒抗原检测试剂产品。
3月15日晚,国家卫健委发布《关于印发新型冠状病毒肺炎诊疗方案(试行第九版)的通知》,内容指出在核酸检测基础上,增加抗原检测作为补充,进一步提高病例早发现能力。
自此,抗原试剂正式纳入《新冠肺炎诊疗方案》,随后,多省持续跟进,集采的相关方案也陆续发布。目前,已有广东省、浙江省、天津市等多地发布了挂网通知。

此外,广东省在3月16日发布了关于调整新冠抗原检测试剂盒价格的通知,中选企业广州万孚生物技术股份有限公司主动申请将中选品种新型冠状病毒(2019-nCoV)抗原检测试剂盒(胶体金法)(国械注准20203400830)价格调整为9.8元/人份,2022年3月16日起执行调整后的中选价格。
合壹汇医疗观点
日前,合壹汇医疗已对抗原检测试剂的适用性问题做过分析(详见《新冠抗原检测试剂获批!千亿市场前景如何?》),通过对自测盒价格、检测结果认可度等多维度进行了解,抗原检测试剂的市场认可度其实并不如预期可观。
如今,随着官方正式定调抗原检测试剂盒的使用场景,各企业检测试剂相继获批,以及多地集采的开展,抗原检测试剂的竞争将急剧激烈,多方因素作用下,最终价格也将大幅度下降,市场规模或将缩水。