一、产品概述
(一)产品结构及组成
放射性粒籽植入专用穿刺针由针管、针座、衬芯、衬芯座及限位环组成。
(二)产品适用范围
配合放射性粒籽防护植入器使用,将放射性粒籽植入至肿瘤靶向位置,用于肿瘤介入内放疗。
(三)型号/规格
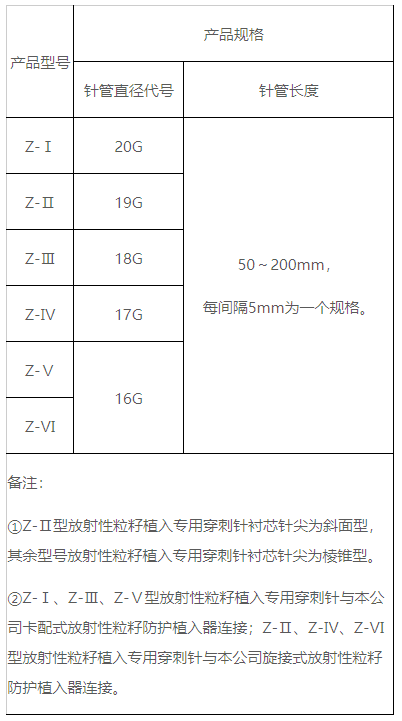
(四)工作原理
放射性粒籽植入专用穿刺针配合放射性粒籽防护植入器,将放射性粒籽植入至肿瘤靶向位置。放射性粒籽植入专用穿刺针在影像设备引导下,利用衬芯进行穿刺、导向,在植入靶点定位正确后拔出衬芯,使针管形成粒籽植入通道,针座用来连接放射性粒籽防护植入器。
二、临床前研究概述
(一)产品性能研究
该产品性能指标包括针管刚性、针管韧性、针管耐腐蚀性、连接牢固度、微粒污染、重要部位尺寸、配合性能、化学性能、环氧乙烷残留量、细菌内毒素等。
申请人针对上述性能指标进行了检测,提供了天津医疗器械检测所的检测报告,被检产品符合产品技术要求。
(二)生物相容性
该产品为外部接入器械,接触部位为组织/骨,接触时间为短期接触。
申请人依据GB/T 16886系列标准进行了生物相容性评价,提供了细胞毒性、皮肤致敏、皮内反应、急性全身毒性和热原试验报告,生物相容性风险可接受。
(三)灭菌
该产品采用环氧乙烷灭菌,无菌状态提供。申请人提供了环氧乙烷灭菌确认报告,证明无菌保证水平为10-6。
(四)产品有效期和包装
产品有效期为3年,申请人提供了3年加速老化试验报告。申请人对产品的包装方式进行了规定并提供了验证报告。验证试验主要为无菌包装封口过程确认报告、产品包装运输验证报告等,包装完整性符合设计要求。
三、临床评价概述
申请人采用同品种比对路径开展临床评价。按照《医疗器械临床评价技术指导原则》要求提交了临床评价资料,证明申报产品与同品种医疗器械基本等同,二者差异不会对申报产品的安全有效性产生不利影响。
申请人申请境内第三类医疗器械产品注册,该产品为境内同品种首个医疗器械,注册申报资料齐全,符合要求。
依据《医疗器械监督管理条例(国务院令第 680 号)、《医疗器械注册管理办法》(国家食品药品监督管理总局令 2014年第 4 号)等相关医疗器械法规及配套规章,技术审评经系统评价产品安全性和有效性后,基于当前认知水平,认为该产品受益大于风险,注册申报资料符合现行技术审评要求,建议予以注册。